第160回「AF2、生命科学・創薬加速」
AIで構造推定
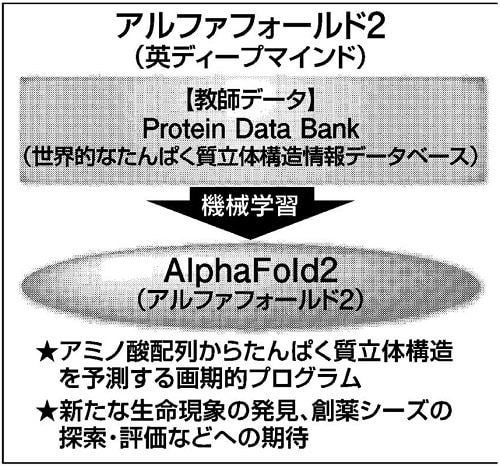
アミノ酸配列からたんぱく質の立体構造を推定する人工知能(AI)プログラム「アルファフォールド2(AF2、英ディープマインド)」は、2021年7月に公開されるやいなや、生命科学や創薬に関係する研究者に衝撃を与えた。
たんぱく質は、さまざまな分子と複雑に相互作用をし、生体内で多様な役割を担う。たんぱく質の立体構造を解明すると、相互作用の予測が可能となる。
従来、たんぱく質の立体構造は、熟練の研究者が、試行錯誤を経てようやく解明に至る。多くの研究者にとって、たんぱく質の立体構造情報は敷居が高く、縁遠い存在であった。しかし、AF2の登場により、立体構造情報になじみの薄い研究者であっても気軽に立体構造の推定が可能となり、生命現象の理解や創薬などの加速が期待される。
革新の原動力に
AF2の登場は衝撃的であったが、現時点では改良すべき点も多く、発展途上の段階だ。例えば、AF2はPDBという国際的なたんぱく質立体構造データベースの情報を元に学習しているため、PDBに類似構造が存在しない場合、予測精度は大きく下がる。
また、固定した立体構造をとらず揺れ動くたんぱく質、生体内の状態に応じて複数の立体構造をとるたんぱく質、一つのアミノ酸の変化で立体構造が変化する変異たんぱくなどの予測は難しい。新たな創薬標的カテゴリーとして注目を集めるたんぱく質―たんぱく質間相互作用(PPI)など、複数分子の相互作用の予測も現時点では難しい。
しかし、それらの困難は徐々に解決されていくであろう。現在、世界中の多くの研究者がAF2に注目し、改良に向けた試行錯誤が続けられている。これに近い状況として、2013年に登場したゲノム編集技術(CRISPR/Cas)が思い起こされる。当初は問題点が山積みであったが、日本を含む世界中の研究者が改良に取り組んだ結果、研究者が日常的に使用する実験ツールとなった。
さらに、エピゲノム編集やRNA編集などの新技術開発も進み、いまや世界中の研究者が注目する技術領域だ。
AF2の登場は、AIによる立体構造推定のスタートラインに過ぎない。
AF2の改良、新技術開発が進むことで、生命科学や創薬に革新をもたらす原動力となるであろう。
※本記事は 日刊工業新聞2022年8月19日号に掲載されたものです。
<執筆者>
辻 真博 CRDSフェロー(ライフサイエンス・臨床医学ユニット)
東京大学農学部卒。ライフサイエンスおよびメディカル関連の基礎研究(生命科学、生命工学、疾患科学)、医療技術開発(医薬品、再生医療・細胞医療・遺伝子治療、モダリティー全般)、医療データ、研究環境整備などさまざまなテーマを対象に調査・提言を実施。
<日刊工業新聞 電子版>
科学技術の潮流(160)AF2、生命科学・創薬加速(外部リンク)
