
研究総括 中内 啓光
(東京大学 医科学研究所 教授)
研究期間:2007年~2013年
特別重点期間:2013年
臓器不全症に対する治療には人工臓器あるいは他人からの臓器移植による臓器置換法が主流であるが、近年、新しい治療法として胚性幹細胞(ES細胞)や人工多能性幹細胞(iPS細胞)などの幹細胞を用いた再生医療が注目を浴びています。しかし現在の再生医療が目指しているのは細胞療法が主体であり、複雑な細胞間相互作用をその発生過程に必要とする臓器を試験管内で再生することは不可能と考えられています。本プロジェクトではBlastocyst Complementation(胚盤胞補完)法を用い臓器を異種動物個体内で再生することを目指し、(1)小動物を用いてのコンセプトの検証(2)大動物による臓器再生・移植を進め、世界で初めて、異種動物個体内で膵臓を作製することに成功しました。また、造血幹細胞の制御機構の解明など臓器再生の基になる知見も得られました。将来的にヒト臓器が家畜を利用して再生できるようになれば、多くの患者を救済できるだけでなく、ヒトの臓器や組織を利用した創薬や医療関連産業にも画期的進歩をもたらすことが予想されます。
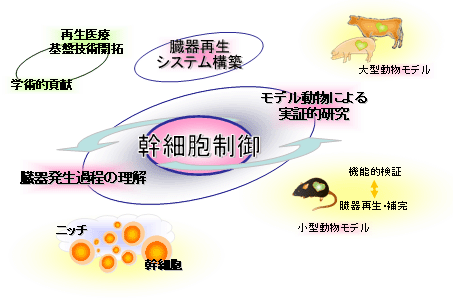
研究成果集
1)多能性幹細胞を用いてマウスの体内でラットの膵臓を作製することに成功
膵臓ができないように遺伝子操作したマウスの受精卵が胚盤胞(受精3~4日後)に達した段階で、正常なラット由来の多能性幹細胞を内部に注入し、仮親の子宮へ移植。その結果、生まれてきたマウスには膵臓が存在し、膵臓を構成する実質細胞は全てラットの多能性幹細胞由来の膵臓に置き換わっていた。また、このマウスは成体にも発育し、インスリンを分泌するなど臓器としても正常に機能した。これにより本プロジェクトの概念が原理的に実施可能であることが裏付けられた。
マウスとラットという種を超えた胚盤胞補完法に成功したことから、本研究成果を応用すれば、ヒトの臓器がどのように形成されるのか、そのメカニズムを異種動物の体内で解析することが可能になる。さらに大型動物の体内でヒト臓器を再生するといった、全く新しい再生医療技術の開発に道を拓く研究成果である。
本研究成果は小動物モデル研究グループが中心となり行われたものである。なお本研究の重要な実験材料となったラット多能性幹細胞の樹立に関しては、共同研究先である自然科学研究機構 生理学研究所が分担・指導した。また再生された膵臓の生理機能の解析は共同研究先である東京大学医科学研究所が分担した。
“Generation of rat pancreas in mouse by interspecific blastocyst injection of pluripotent stem cells.”, Cell 142, 787-799, 2010
2)神経系による造血制御の機構を発見
本研究では造血幹細胞の冬眠状態に着目し、骨髄ニッチには造血幹細胞の細胞周期を止めて冬眠を維持する働きがあるという仮説をたて、造血幹細胞の細胞分裂を抑制する分子をスクリーニングした。その結果、サイトカインの一種である活性型TGF-βが造血幹細胞の分裂を抑制することを見出した。そこで活性型TGF-βの骨髄中における存在場所を詳細に検索したところ、血管様構造をとる細胞であることが判明。さらにその血管様細胞がどのような細胞なのか詳しく解析を進めていったところ、驚くべきことにTGF-βが貯まる場所は血管細胞ではなく、血管と並行して局在する神経系の細胞であることが確認された。さらに詳しい解析から、この神経細胞はグリア細胞の一種である非ミエリン髄鞘シュワン細胞(non-myelinating Schwann細胞)であることが明らかとなった。以上、本研究では造血幹細胞の冬眠状態を維持する骨髄中のニッチを構成する細胞として神経系細胞の一種であるグリア細胞が関与していることを明らかにした。
本研究成果は小動物モデル研究グループが中心となり行われたものである。なお本研究で用いた各種遺伝子改変動物は、京都大学、Lund大学、昭和大学より提供を受けた。
“Nonmyelinating Schwann cells in mouse bone marrow niche maintain hematopoietic stem cell hibernation through TGF-beta signaling”, Cell, 147, 1146-1158, 2011
3)膵臓欠損ブタの作出と、これを利用したブタにおける胚盤胞補完による膵臓の作出に成功
膵臓の形成を抑制する機能を持つPdx-Hes1遺伝子を導入することにより膵臓欠損ブタのラインを確立した。このクローン胚由来の胚盤胞を宿主とし、正常ブタ由来のクローン胚細胞をドナーとした胚盤胞補完により、膵臓欠損ブタに外来性同種細胞由来の膵臓を作出することを試みた。Kusabira-Orange遺伝子導入ブタ、Pdx1-Venues遺伝子導入ブタおよび有色野生型ブタ由来のクローン胚細胞で補完(complementation)する実験を行った。合計354個の補完胚(キメラ胚)を5 頭のレシピエントに移植して得た24頭の産仔を解析した結果、5 頭(20.8%)がキメラであり、膵臓が再生していることが確認された。以上から、ブタにおいても膵臓形成不全のクローン個体の作出が可能なこと、その表現形を補完法によって修復可能なことが証明された。本来なら致死である膵臓欠損ブタは胚盤胞補完により成体まで生存し、正常な血糖値 を示していることから、この膵臓が正常に機能していることが確認された。さらに交配させることも可能であり、次世代胎仔の表現系の確認(野生型ブタとの交配では半数の胎仔で膵臓欠損が生じた)にも成功した。以上の成果は本プロジェクトの開始時点で構想した、臓器欠損動物の作成と、胚盤胞補完による臓器の作出が大型動物でも可能であることを証明するものであり、大動物個体内でのヒト臓器作出にむけて重要な成果である。なお、本研究は大動物モデル研究グループが中心になり行われたものである。
“Blastocyst complementation generates exogenic pancreas in vivo in apancreatic cloned pigs”, Proc. Natl. Acad. Sci. U.S.A. 2013 Mar 19;110(12):4557-62.
研究成果
評価・追跡調査
※本プロジェクトは、ERATO研究期間終了後継続して、平成27年11月まで研究加速強化システムによりJSTが支援を行いました。