
研究総括 宮脇 敦史
(理化学研究所 脳科学総合研究センター シニア・チームリーダー)
研究期間:2006年~2012年
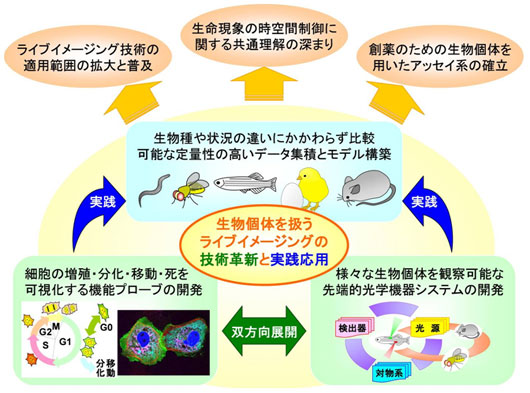
生体としての調和のとれた形態形成や生理的活動は、それを構成する個々の細胞が互いに連絡し合い、時空間的に正しく機能することで実現されます。細胞の活動の様子を知るために、ディッシュに培養された状態での計測がよく行われます。しかし、このような人工的な環境では、生体内での細胞の活動を正しく反映できるとは言い難いです。本プロジェクトでは、細胞が示す増殖や移動,分化などといった様々な生命現象を、本来の活動の場である生物個体の中で計測することで、その時空間的制御のメカニズムを解明することを目指しました。そのために、細胞が起こす生命現象を光の強さや色の変化として検出するための、蛍光あるいは発光を利用したプローブを創出しました。そして、個体に発現されたプローブからの光を三次元的に高い解像度で観察し、その時間変化を可視化するための顕微鏡システムと計測技術を開発しました。これらにより、生物個体を対象としたライブイメージングの技術革新とその実践的応用を行いました。
研究成果集
A:生物個体ライブイメージンググループ
生物個体ライブイメージンググループは、細胞が示す生命現象を光の強さや色の変化として捉えることができる、蛍光または発光プローブの開発をめざした。プローブの設計や導入法を検討することで、これらを安定して発現する生物個体を作製し、そのシグナルをイメージングにより解析することを目標とした。さらに、これらの医療分野、創薬などの産業分野への応用を検討した。
1)生物個体内の細胞周期の時空間的制御の可視化
細胞周期をリアルタイムに可視化する蛍光イメージング技術を開発した。これにより、細胞周期に伴って起こるDNAの複製と細胞分裂という基本的な生命現象のタイミングを蛍光の色の変化として捉えることができるようになった。この技術は、細胞周期の特定の時期にのみ存在する2種類の蛋白質を選び、それぞれを色の異なる蛍光蛋白質で標識したプローブ、Fucciを作製することで実現した。このプローブを細胞に導入すると、分裂後からDNA複製前の時期(G1期)にある細胞の核は赤色の蛍光を、DNA複製から分裂の時期(S/G2/M期)にある細胞の核は緑色の蛍光を発するようになる。この技術を利用して、マウスに移植した癌細胞の浸潤、転移や、マウスの胚で起こる神経細胞の分化、移動などにおける細胞周期進行の時空間パターンを観察することに成功した。今後は、ES細胞やiPS細胞の増殖と分化誘導、腫瘍細胞の悪性度の評価、細胞増殖に関わる疾患に対する薬剤のスクリーニングなど、医療、産業面での応用についても検討する。(Sakaue-Sawano A. et al., Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell, 132, 487-498, 2008, Sakaue-Sawano,A. et al., Drug-induced cell cycle modulation leading to cell-cycle arrest, nuclear mis-segregation, or endoreplication. BMC Cell Biol., 12, 2, 2011)
2)ゼブラフィッシュ胚の発生過程での細胞周期と分化の進行をイメージング
先に開発されたFucciの改良により、ゼブラフィッシュで機能する細胞周期プローブを開発した。プローブを発現させたゼブラフィッシュ胚でタイムラプスイメージングを行い、様々な器官形成における細胞周期の進行を観察した。その結果、特徴的な現象として、脊索の分化に伴って頭部から尾部へ伝播する2つの細胞周期遷移の波を初めて検出することができた。G1期にある脊索前駆細胞の配列において、頭部から尾部に向かってG1-S遷移が起こり、その後G2期にしばらくとどまった後、頭部から尾部に向かってM-G1遷移が起こることで脊索の分化が完了していく様子を捉えることができた。これにより、細胞の増殖と分化が協調しながら個体の形成が進行する様子を確認することができた。(Sugiyama, M. et al., Illuminating cell-cycle progression in the developing zebrafish embryo. Proc. Natl. Acad. Sci. USA, 106, 20812-20817, 2009)
3)オートファジーの活性を可視化するプローブの開発
細胞がもつ蛋白質やオルガネラの分解経路としてオートファジーが知られている。我々は、蛍光蛋白質mKeimaのオートファジーの測定に適した特性に着目し、これをプローブとした簡便なオートファジー活性の測定法を開発した。オートファジーでは、分解を受ける細胞質成分は最終的にpHが酸性のリソソームに取り込まれて分解される。mKeimaは、酸性pHでも変性、失活せず、リソソーム内の分解酵素に対して耐性を持ち、なおかつ酸性域と中性域とで励起スペクトルを大きく変化させるという特性がある。オートファジーは細胞質の不特定の場所で起こるが、細胞に発現させたmKeimaのうち、オートファジーの経路に入ったものは、最終的にリソソームに輸送され、その中で分解されずに蓄積する。そこで、リソソームに入ったmKeimaの蛍光を検出し、これをオートファジーのシグナルとして測定した。オートファジー系の異常が神経変性疾患などの原因になることが示唆されている。今後、mKeimaを疾患に関連する蛋白質やオルガネラに融合させて測定することで、その発症のメカニズムのを解明するための研究や、臨床検査法としての応用が期待される。(Katayama,H. et al., A sensitive and quantitative technique for detecting autophagic events based on lysosomal delivery. Chem. Biol., 18, 1042-1052, 2011)
B:光学システム開発グループ
光学システム開発グループは、生物個体に発現されたプローブからの蛍光や発光をイメージングするための顕微鏡システムや、生体試料を顕微鏡のステージ上で長時間維持させるインキュベータなどの周辺装置など、ハードウェアの開発、改良を行うことを目標とした。また、多光子励起顕微鏡などの既存のシステムに関しても、その操作性の向上と新たな応用について検討を行った。
1)多光子励起顕微鏡によるマルチカラーイメージング
多光子励起顕微鏡の応用として、ストークスシフトが大きい蛍光蛋白質を利用したマルチカラーイメージング法について検討した。蛍光蛋白質mKeimaは、励起波長のピークが440 nm、蛍光波長のピークが620 nmとストークスシフトが非常に大きいことが特長である。この特性を利用すると、mKeimaと同じ励起波長を示す蛍光蛋白質でも蛍光を分離することで、同時にイメージングすることが可能になる。蛍光蛋白質の二光子吸収断面積を測定したところ、ECFPやEGFPなどで、そのスペクトルがmKeimaと重なりを持つことがわかった。そこで、細胞の核やミトコンドリア、小胞体などのオルガネラをmKeimaとECFP、またはmKeimaとEGFPで染め分けて二光子励起イメージングを行い、それぞれ1つの励起波長で、同時に2色の蛍光のイメージングが行えることを示した。(Kawano H. et al., Two-photon dual-color imaging using fluorescent proteins. Nat. Methods, 5, 373-374, 2008, Kogure T. et al., Fluorescence imaging using a fluorescent protein with a large Stokes shift. Methods, 45, 223-226, 2008)
2)生体組織の透明化技術の開発
生体組織の深部を光学的に観察しようとする場合、光が組織内部で散乱するため、深くなるにつれて像がぼけてしまうという問題がある。我々は組織を透明化する試薬Scaleを開発し、組織を破壊することなく表面から数mmの深部を高精細に観察する技術を確立した。Scaleは尿素、グリセロール、界面活性剤を成分としている。ホルマリン固定したマウスの脳をこの試薬で処理したところ組織が透明になり、あらかじめ蛍光蛋白質YFPで標識された神経細胞の蛍光は消失することなく保持されることが確認された。二光子励起顕微鏡によりイメージングを行い、脳表面から、皮質、白質、海馬の歯状回にいたる神経回路の三次元構築を行うことができた。Scale技術の開発により、生体組織の構造を広視野かつ高精細に三次元構築することが可能となった。(Hama, H. et al., Nat. Neurosci., 14(11), 1481-1488, 2011, Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain)