京都大学の山中伸弥教授が2012年にノーベル生理学・医学賞を受賞してからというもの、iPS細胞という言葉が期待と不安を背負って社会に定着した。期待とはもちろん、どんな細胞にも変化することができるiPS細胞によって、再生医療に弾みがつき、これまでは治療困難とされてきた病気を治せる道が開かれることだ。一方、不安とはそのための治療費がどれほどかかり、かつ医療保険財政にどのような影響を与えるかである。

年間薬剤費が3000万円を超えた
再生医療を担うのはiPS細胞(人工多能性幹細胞)だけではない。体性幹細胞やES細胞(胚性幹細胞)を使った治療も開発中だ。すでに保険診療が可能になった再生医療は心筋シートなど7種ある。しかしコスト面のハードルは高い。近年話題になっている分子標的薬に象徴されるような新しい薬や治療法は、高額になる傾向がある。例えば京都大学の本庶佑特別教授がノーベル賞を受賞したニボルマブ(薬品名オプジーボ)は当初、年間の薬剤費が3000万円を超えた(その後、適用範囲の拡大により薬価は引き下げられたが、それでも1000万円以上の薬剤費がかかる)。ある試算では、一部の患者に投与するだけで、年間1兆7500億円の薬代がかかるという。
『コストの観点からみた再生医療普及のための学際的リサーチ』という研究プロジェクトを立ち上げた神奈川県立保健福祉大学の八代嘉美教授は、動機についてこう語る。「コストが高止まりしがちな状況をそのままにしておくと、いずれどこかで壁にぶつかり、普及しなくなってしまう。あらかじめ何が障害となるかを知っておきたかった」
再生医療を取り巻く環境は2014年に大きく変わった。臨床研究や自由診療に焦点を当てた再生医療等安全性確保法ができ、また従来の薬事法が医療品医療機器等法(薬機法)に改正された。再生医療の安全性確保に指針が示されたことによって再生医療の保険収載も加速され、「アメリカなどと比べてもさして遜色はなくなった」(八代教授)という。
スケールメリットって本当?
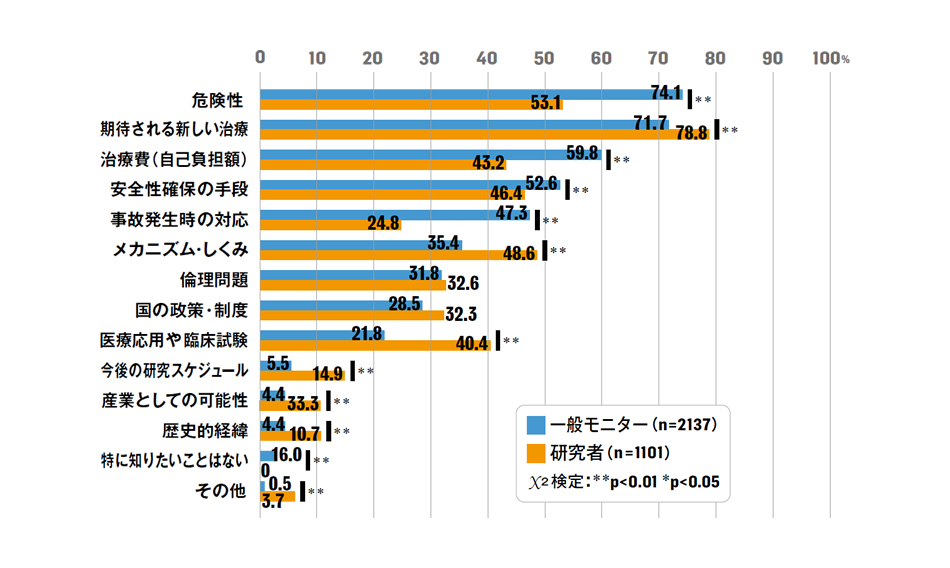
研究の入り口になったのは「再生医療を社会がどう受容しているかというところ」と八代教授は言う。社会の側の意識と研究者の意識を調査したところ、気にすることの優先順位にずいぶんずれがあった。大きくずれるのは、一つは安全性の問題だが、もう一つはやはりお金の話だという。
研究者は一般に臨床研究している段階で、コストの話や有効性、安全性がどうなるのかはまだ分からないと考える。「しかし」と八代教授は言う。「研究者は国民からそうした医学的なものを切り拓くことを付託されているのだから、分からないから答えないというのはやはりよくないでしょう」
コストに関しては、実際に製品化すればスケールメリットが出るから価格は下がるはずだというようなことがよく言われる。しかし再生医療に関してはそう簡単ではない。「再生医療のターゲットというのは、どちらかというと患者がそうたくさんはいないゾーンを狙っているものが多い。治療効果がはっきり出そうなところを狙うとすると、遺伝性であるとか、あるいは極めて重篤である疾患みたいなものを選ばざるをえなくなる傾向にあります」(八代教授)。これではスケールメリットはあまり出てこない。場合によっては個人の細胞からその都度作ったほうがコストはかからない場合もありうる。
「薬というのは、工業生産品として一定の基準内に収まるものを出荷しなければならない。そのためには原料となる細胞が均一性を担保される必要がある。例えばiPS細胞であれば京都大学のiPS細胞研究所から出荷された細胞をいったん製薬会社で増やして、セルバンクというものを作る。マスターセルバンクとワーキングセルバンクの二つです。そして安全性を確認するために検査をしなければならない。最終的に製品として認めてもらうために、そういうプロセスが必須なのです」
ただ工業品と違うところは、細胞であるという点だ。現に、出荷された細胞を目的の細胞に分化させたときに遺伝子異常や染色体異常が発生したことがある。そういったエラーが起こりうるということになれば、安全性を確保するために、いろいろな段階で試験をせざるをえない。
規制のあり方がコストを左右
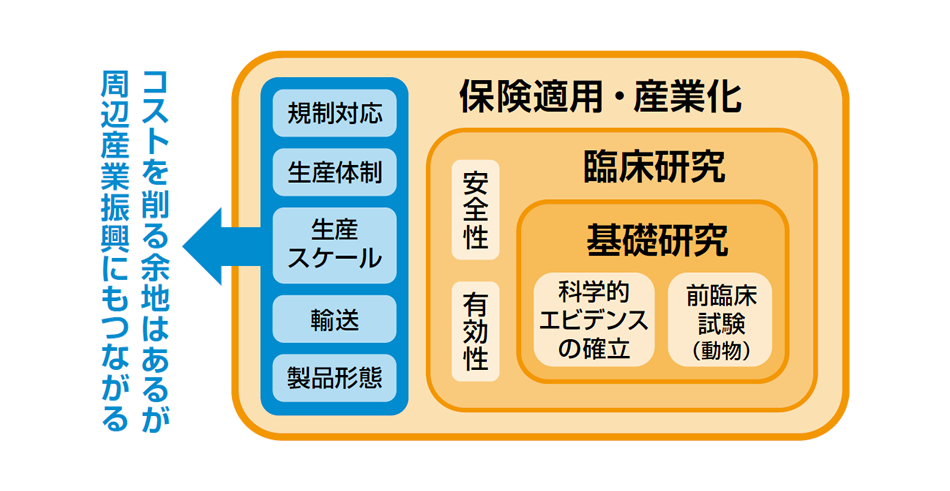
再生医療等製品は、化学工業品とは違って各生産段階で一定の品質を保とうとするとどうしてもコストがかさむ。そのため、製品価格は高額になりがちだが、医療費として投じられるお金は医療提供や材料費、製造コストを補填するだけではなく、周辺産業の振興にもつながる
当然、プロセスが増えるほどコストがかさむ。一方、患者の細胞から作るときは、その細胞自体の安全性が担保されるかどうかを見ればよいので「均一性というのはあまり見なくてもいい」(八代教授)。これで検査プロセスが一つ減ることになる。こうして考えると現状ではスケールメリットといってもそう簡単には出ないかもしれない。
規制のあり方がコストに直結
プロセスを規定しているのは規制だ。「この規制の状況が適切かどうか、厚労省やPMDA(医薬品医療機器総合機構)などと一緒に考えなければなりません」と八代教授は言う。そこで取り組んだのが、安全性を知るための科学的な根拠を調べることだ。そのためには細胞を扱ってルールに落とし込むための人材が必要だ。いわゆるレギュラトリーサイエンス(規制科学)である。「しかしそうした細胞とか、遺伝子治療とかの分野が分かる規制の人材が多くないのです」
現在、レギュラトリーサイエンスを教えているのは基本的に薬学部だけだが、薬学部では細胞生物学や分子生物学は重視されない。逆に医学部や理学部、農学部で安全性を確保するためのGMP(適正製造規範)やGLP(優良試験所規範)の教育はほとんどない。「結果、細胞を使った製品のレギュラトリーサイエンスが分かる人材が全然足りない」と八代教授は言う。
規制のあり方は、実用化されるときのコストに直結してくる。八代教授は言う。「マーケットの拡大というのもあるでしょうが、そのためにもまずは再生、細胞治療に適した形での規制のあり方を改めていかなくてはならないでしょう。実際に承認されている製品のコストを分析してみると、規制に対応するための費用が非常に大きいことが分かります。いわゆる品質管理、品質保証、搬入される機器や資材の管理などで4割ぐらいを占めます」
それは製品の一定性を確保するために、各段階で検査が入るからだ。ひとつの工程が終わると検査、次の工程が終わると検査が入る。これが普通の医薬品であれば、中間産物についてそこまで厳密に管理しなくてもよく、入口と出口できちんと一定性が担保されていればよかった。「でも再生・細胞の場合は、入口と出口が一定であっても中間のところで変動しているかどうかが分からないということもあって、中間の検査が行われる」(八代教授)。これを続ける限りは、この工程で6割から7割を占める人件費を圧縮することは難しいという。逆に言うと規制に対応するために生じているコストを見ていかないと、コストをそう簡単に落とせないという。
品質管理や品質保証が大きなコスト要因になっているのは日本だけではない。アメリカでもほとんど同様だと八代教授は言う。薬事の国際的なガイドラインはICH(医薬品規制調和国際会議)で決められる。このガイドラインを満たしていないと他国に製品を輸出するときに問題が生じることになる。
「いま出てきている製造管理方法としてはクォリティ・バイ・デザイン(QbD)という考え方があります。端的に言うと、細胞の性状を考えた上で、細胞のパラメーターが変動しても最終的にはデザインされた形に収束する設計思想にしようということです。普通の薬については、すでにこの考え方が取り入れられていて、実際に承認されるものも増えている。再生・細胞医療でもそうした取り組みをしていかないといけない」(八代教授)。
日本の場合は、世界に先駆けて条件付き早期承認制度を導入したため、審査や承認のプロセスについては先駆的な国の一つと見なされている。ただ問題は、国際的にハーモナイゼーションが必要な製造過程の品質管理に関する規制について、それを世界という舞台で推進していく人材が圧倒的に少ないということだ。「その結果、欧米や中国に置いていかれてしまう」(八代教授)状況が生まれている。そういう意味では、再生・細胞医療の研究開発を推進するのは重要だが、それと同時に、規制のあり方やコストの問題、財政への影響等を幅広く考えることができる人材をどのように育成していくのかが重要だ。言い換えれば、エコシステムを考えなければならないということだ。
エコシステムを求めて
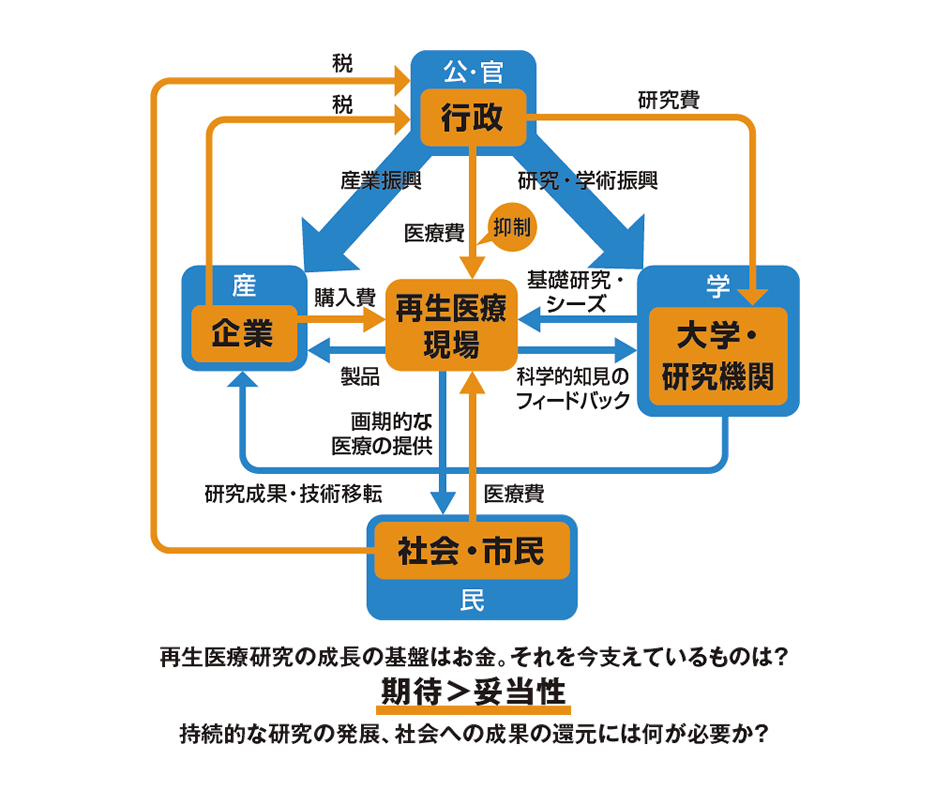
なぜエコシステムが必要なのか。それは技術開発だけでは社会に定着しないからだ。技術開発の成果が社会に届くためにはそのためにカスタマイズされた規制のデザインが必要だ。しかしこれまでは、研究開発の推進と規制のデザイン、さらにはビジネス化がばらばらになっていた。これを統合しなければ、研究は研究、規制は規制、ビジネスはビジネスというこれまでの状況から抜け出すことができない。
再生・細胞医療で言うと、シーズの開発を中心に、規制のデザイン、品質管理の技術の向上、サプライチェーンのマネジメント等、再生・細胞医療をとりまくさまざまな要素がばらばらに進められてきた。結果として、個々に知見や成果が生み出されてきたが、エコシステム全体を俯瞰した政策の策定には至っていない。
財政が豊かであったときには、医薬品や治療のコストが高くなっても、吸収することができた。しかし、情勢は変わる。医療保険財政が逼迫してきたのに加えて、飛躍的な技術進歩に伴って製品や技術の価格もまた飛躍的に高くなることが増えてきた。オプジーボの例はすでに挙げたが、最近実用化された画期的な白血病治療薬キムリアは、患者一回の薬剤費が3349万円にも達する。
多くの人に科学技術の成果を享受してもらうためには、保健財政のもとで高額の薬剤や再生・細胞医療を提供することが必要だ。そのためには、製品や技術の安全性・有効性を一定程度担保しつつ、価格を安くするための技術と制度を工夫することが求められる。
そのためには補助金のあり方も再考する必要があるかもしれない。厚労省、文科省、経産省のそれぞれが所管していた医療分野の研究開発事業を再編・統合することで2015年に発足したAMED(国立研究開発法人日本医療研究開発機構)にしても、やはり各省の縦割り色が残っていると八代教授は言う。どのような目的のために、どの研究のどういった要素をサポートするべきなのか、的確にサポートをするためにはどのような資源やネットワーク化が必要なのか、まさにエコシステムの戦略が今こそ求められていると言えそうだ。
(文・藤田 正美)