かつて、日本の経済政策の現場で「ディレギュレーション」という言葉が流行語になっていた時代がある。官僚はこれを「規制緩和」と訳したが、正確には「規制撤廃」のほうがニュアンスは近い。緩和と言っておけば、そのさじ加減は規制当局が握ることになる。当時は世界的にさまざまな分野でこのディレギュレーションが進んだ。規制があるために、企業の挑戦が阻害され、あらゆる面でイノベーションが窒息させられているという問題意識があったからだ。
ひるがえって現代。医療にせよITにせよ、新しい技術の最先端にむしろ規制が追いつかないという事態が生じている。そのため「レギュレーションがないからイノベーションが起きない」と加納信吾准教授(東京大学大学院新領域創成科学研究科)が言うように一種の逆転状態がある。

レールがなければ電車は走れない
加納准教授には苦い「原体験」がある。それはまだ大手シンクタンクでコンサルタントをしていたころだ。アメリカから遺伝子治療に関する新しい技術を日本に導入しようと、企業に話を持って行った。しかし先方から意外とも思える反応が返ってきた。「せっかくですが、これは規制がまだないので、うちでは導入できない」という。規制がどうなるか分からないということは、リスクが大きいということでもある。先行投資しても商品にはならないかもしれない。いくら技術的に最先端であってもそれでは企業にとってリスクが大きすぎるというのである。
加納准教授は言う。「レギュレーションがないから研究が進められない。レールがないから走れない。医療関連だからという特殊性もあるかもしれないが、規制がないから新しいことができないという典型だったわけです」
こんな例え話が分かりやすいかもしれない。新しい道路がある。まだ制限速度が設定されていない。ドライバーはそこをどれだけのスピードで走ればいいか迷う。ひょっとすると高速並みの道だろうか、ひょっとするとくねくね曲がった道だろうか。乱暴なドライバーは別として、研究者ならば絶対安全と思える時速20キロで走ろうとするかもしれない。そうなるとイノベーションは進まないし、世界に後れを取ってしまう。
アメリカでも医薬品や医療機器に関してはFDA(アメリカ食品医薬品局)という規制当局がある。アメリカの中でも、FDAがあるためにイノベーションが進まないと文句を言う人々がいる。しかし「よくよくその議論を聞いていると、少なくともレールは敷かれている。そのレールが走りやすいか走りにくいという程度の話です。要するにタイミングよくレールを敷設してくれないと、新しいことも進まないわけです」と加納准教授は言う。
予見できないと資金も集まらない
ビデオデッキの世界では、かつてベータマックスとVHSという二つの規格が覇権を競った。結局、民生品ではVHSの圧勝という形で終わったが、ここに規制があったわけではない。業界の力関係もあって、二つの規格に収斂し、その二つが並行して走った。
しかし医療の世界ではそうはいかない。医薬品は人間が飲むものだ。よく分からないものは人間に適用することが許されない。だからある程度のプロポーザルが出た段階でルールを決めざるをえない。加納准教授は言う。「ルールができれば、新たにそこに参入してくる企業も生まれるわけです。要するにルールがないのに事業計画は書けません。その意味で、もう少しルールがいつできるかという予見性を高めないと、ルールがないからやらないということになってしまう」
これではイノベーションは進まない。一つの例を挙げる。マイクロマシンができたとする。血管にマイクロマシンを入れて、患部に送り込んで治療する。治療が終われば排出される。このマシンを投資家に提案しても何と言われるか。「投資家からこう聞かれます。『レギュレーションはありますか。もしなければ投資できません』と言われてしまう」
原技術・原技術の評価技術・評価技術の評価
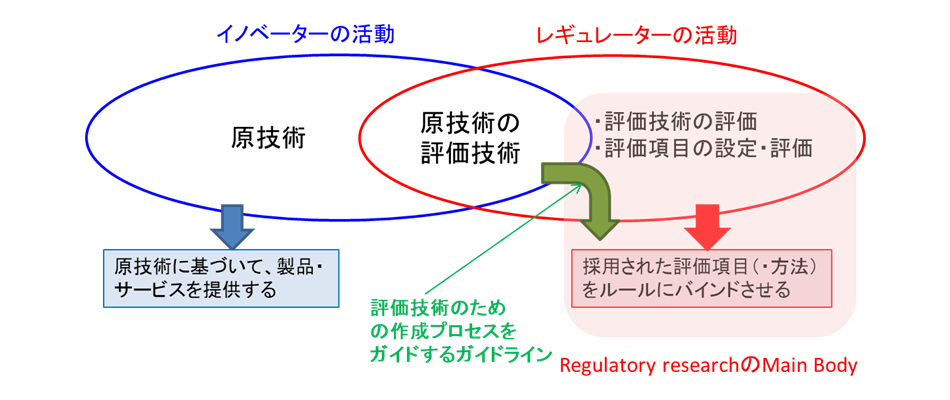
新規技術や新規製品カテゴリーの評価に必要な評価技術を審査に利用するには、そのための汎用的な評価技術のためのガイドラインの整備が重要だ。これにより新しい原技術とそが登場したとき、迅速にそれらを審査に組込み、技術標準の作成に用いることができる
そこで開発者は、こういうマシンができたのでルールを作ってほしいと規制当局に要請する。そこから何年も経ってようやくルール作りが始まる。これでは開発のためのお金が集められない。こうやってプロジェクトはいわゆるレギュレーションの「死の谷」に落ちてしまう。
投資家の側から見れば、レギュレーションがないということは、その技術シーズがやがて市場に出て行くかどうかをまったく見通せないということだ。それが必要条件で、その後に、規制をクリアする可能性が見込めるかというのが十分条件だ。ここが揃わないと、投資家にとってはリスクの取りようがない。
医薬品の場合はルールがきっちりある。臨床試験に至るまでどういうことをすればいいか、臨床試験で何をすればいいか、開発者も分かっている。だから製品化までのタイムラインをおおまかに引くことができるし、投資家にも説明できる。
しかし医療に使われるのは薬品だけではない。医療機器には、CTやMRIのような診断機器もあるし、医師が治療行為のために使う治療機器もある。最近の医療機器には機器の性能を常時アップデートするソフトウェアのようなものに加え、医師の診断を支援するAIまで登場しつつある。医薬品に比べて製品のライフサイクルが短く、常に新しいものが登場する医療機器をどこまでタイムリーに、そして安全に医療に持ち込んでいけるか。「もう少しルールが作られるプロセスが見えるようになって欲しい。ルールを作ってもらいたいと開発者が要求したら、タイムリーに規制当局が動いてくれる状態が欲しい。今は割と当局の裁量ベースで動いているようにみえます」と加納准教授は言う。
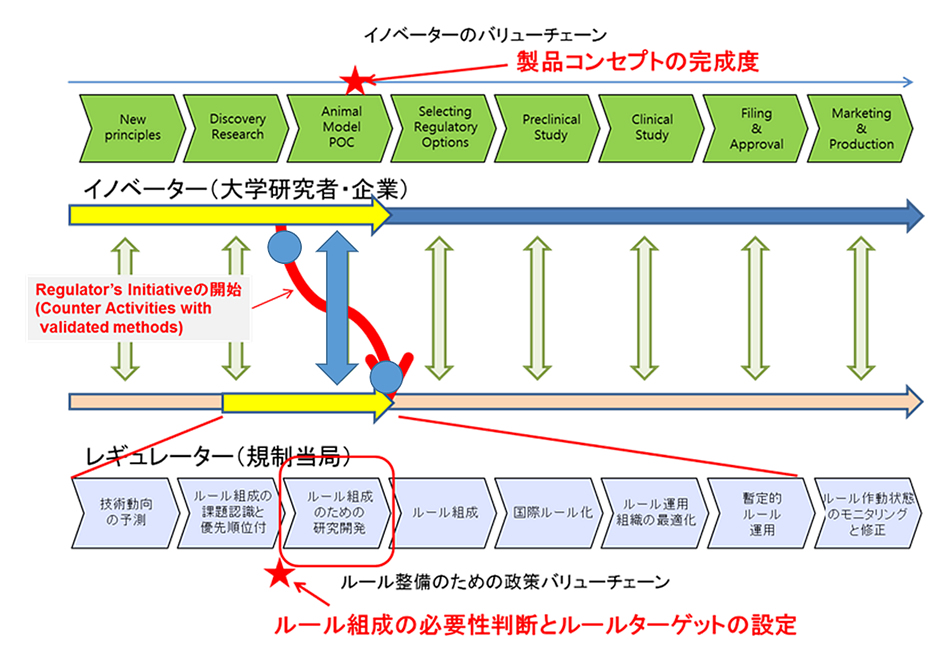
その意味で、加納准教授の研究は規制当局が規制をつくるタイミングとプロセスを観察対象にしたものだということもできる。いわゆるレギュラトリーサイエンスだ。この言葉を国はこう定義している。「科学技術の成果を人と社会に役立てることを目的に、根拠に基づく的確な予測、評価、判断を行い、科学技術の成果を人と社会との調和の上で最も望ましい姿に調整するための科学」(第4期科学技術基本計画、平成23年8月19日閣議決定)。レギュラトリーサイエンスに関する学会もあるが、「それはみな当事者が発表する場です。厚労省や医薬品や医療機器の規制や認可を担っているPMDA(医薬品医療機器総合機構)、関連研究をしている大学の人たちが発表しています。そこにもっと社会科学のコミットメントが欲しいと言われているのだけど、専門知識が必要なのでなかなかそういった研究をする人が増えないのが実情です」と加納准教授は語る。
ルール作りは「煮詰まってから」
外国ではどうか。EU(欧州連合)は統合というプロセスがあったために、フランス、ドイツ、イギリス、イタリアあたりですり合わせをしなければならなかった。政策研究全般にわたって、統合するためにいろいろな理論武装があり、そこに社会科学系の人たちが関わったという経緯がある。ヨーロッパでFDAにあたる機関は、EMA(欧州医薬品庁)で、本部はロンドンに置かれていた(イギリスのEU離脱を受けて本部をアムステルダムに移すことになっている)。
ただ医療の最先端はアメリカだ。レギュレーションも同様である。規制当局であるFDAは規模が大きい。加納准教授によれば、FDAとPMDAの規模感は、宇宙開発におけるNASA(アメリカ航空宇宙局)とJAXA(宇宙航空研究開発機構)ぐらい違うという。予算でいえば日本のほうが圧倒的に小さい。しかし日本発の革新的な製品についてのルールづくりをFDAがやってくれるわけではない。そうなると予算規模で小さい日本がイノベーションで頑張るには、規制当局であるPMDAが効率よくルール作りをするためのプロセス研究をしなければならない。それがもう一つの動機だと加納准教授は言う。
それでも医薬品については、ルールについてある程度世界的に統合されている。しかし医療機器や再生医療については日米欧で規制がばらばらなのが実情だ。さらに日本国内でも難しい問題がある。加納准教授は言う。「ルールをつくるエージェンシーと運用するエージェンシーが分離されていて、ルールのライフサイクル全体を統括する組織がありません。FDAの場合、全権を持っています。しかし日本だと、PMDAと厚労省、国立医薬品食品衛生研究所と周辺の大学などで研究者がばらばらにいる。この体制ではやはり無理があります」
何らかのイノベーションが起きて、それからレギュレーションを作るというのが当然の順番ではあっても、そのルールを作るときのルールを整備しておくのが重要だ。そうすれば予見性も高まり、投資家も動きやすくなるはずだ。今はその「ルール・オブ・ルールズ」がないために、どのタイミングでルールを作るかがかなり当局任せになっている。
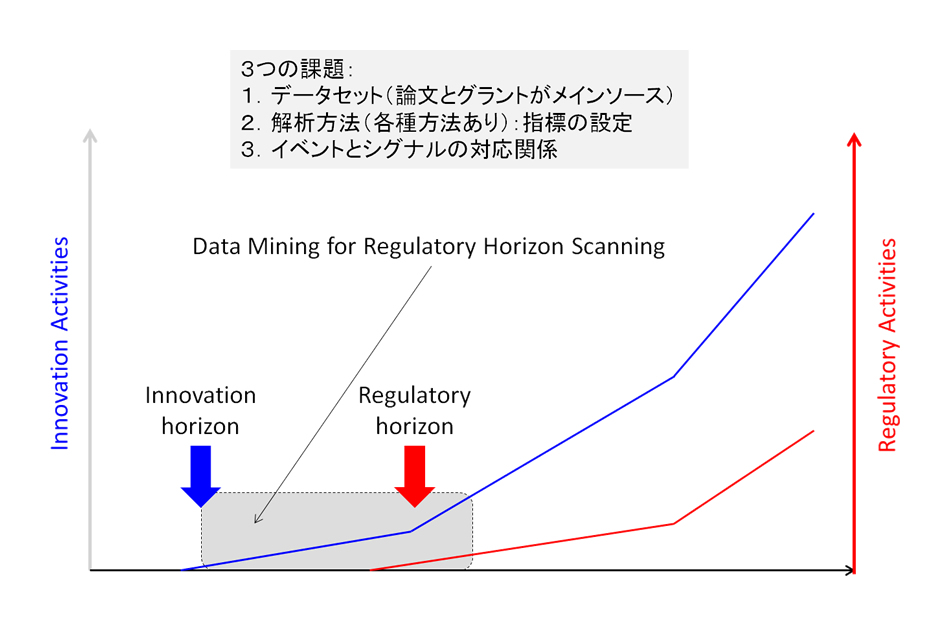
加納准教授は言う。「新しい技術が出てきて、いつそのルールを作るかと聞くと、『煮詰まってから』と言われる。それは名人の皮膚感覚にも似て、その煮詰まり感がいつも正しく判断できるとは限らない。そのタイミングを科学的に測定することができるのか、というのも私たちの問題意識の一つです」
しかしタイミングを科学的に判断するというからには、何かを「計測」しなければならない。言い換えればエビデンスが必要だ。論文の数で測ることもあるが、加納准教授のプロジェクトでは、研究助成金で活動を測定する。
例えば「患者の細胞を採取してそれを軟骨の再生医療に使うという場合、どれくらいの研究助成金がついてきたのか。いつから動物実験が始まって、いつから臨床試験が始まったのか。臨床試験というと企業の段階だけど、その前のところは大学ですから、助成金の動きを見ていれば大学の活動をある程度測れると考えています。その研究助成金の状況から『煮詰まり感』を数字として出すことができるでしょう」
ただ一口に研究助成金のデータを集めると言っても簡単ではない。文部科学省の科学研究費、厚労科研費、NEDO(新エネルギー・産業技術総合機構)、AMED(日本医療研究開発機構)それぞれ独立に助成金のデータベースがあるため、そこからデータを集めて分析するという作業は大変だった。たとえば人の軟骨というようなテーマ別にデータを集め、そこに臨床試験がいつから始まったとか、いつ承認されたか、審査のためのガイドラインがいつ作られたとかいうイベントを並べていくと、研究助成金との関連がある程度見えてくる。それによってルールをつくるプロセスにエビデンスを与えようというわけだ。
ルール作りの仕組みを決めておく
もう一つの問題は、ルールを何によって定めるのかということだ。もちろんルールの根本は法律ということになるのだが、最先端技術について法律で決めてしまうと、それこそ技術の進歩に対応できない。そこは柔軟に対応できるようにしておくことが必要だ。実際、さんざん国会でも追及された「統計不正」問題は、全数調査だの訪問調査というところまで定められていたために、現場が追いつかずに「違法状態」が長期にわたって放置されてしまった。日進月歩の技術革新の時代には、法律で決めなければならないのは、オープンなエビデンスに基づいて専門家がルールを定めるという仕組みでよい。
人口減少が続く日本。その日本を救うものがあるとすれば、それはイノベーションだというのは衆目の一致するところだ。大学改革が叫ばれるのも、そこに一つの理由がある。しかしイノベーションを促進するのは簡単ではない。自由な研究と豊富な資金、それに新しい技術に対応した迅速なルール作り。とくにそのルール作りのプロセスにもイノベーションを起こすことができるかどうか。イノベーション競争はレギュレーション競争でもある。ここが世界の中でガラパゴス化しないでやっていけるかどうかが、日本の将来の分かれ道なるのかもしれない。
(文・藤田 正美)