
研究総括 袖岡 幹子
(理化学研究所 基幹研究所 主任研究員)
研究期間:2008年~2013年
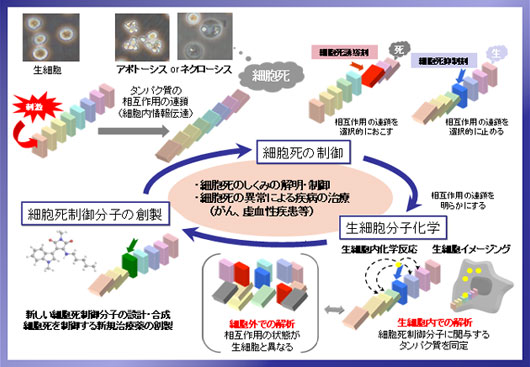
細胞死のしくみの解明は、脳梗塞や心筋梗塞等虚血再灌流傷害や癌などとの関連から、たいへん重要です。本プロジェクトでは、細胞死のなかでも特に酸化ストレスにより誘導されるネクローシスに焦点をあて、細胞死制御分子の創製、細胞死の情報伝達の分子機構の解明、さらにそれらを可能にする新しい化学的手法や解析法の開発を目標として研究を行いました。研究目標の達成のため、化学、生物、工学の異分野の研究者を結集し、細胞死制御グループ、生細胞反応グループおよび生細胞解析グループという3つのグループを組織して取り組んできました。その結果、ネクローシス抑制剤および誘導剤の開発に成功し、これらの化合物をプローブとして用いた作用機序の解明研究を行うことができました。また、低分子化合物の生細胞中でのイメージングや標的タンパク質や結合部位の同定、さらには膜タンパク質複合体の解析のための新しい化学的方法論の開発にも取り組み、ラマン分光や遷移金属錯体などを利用したユニークな手法の開発に成功しました。
研究成果集
細胞死制御グループ
IM-54が生理的な細胞死誘導因子であるFasリガンドや様々な抗癌剤により誘導されるアポトーシスを阻害せず、酸化ストレスによるネクローシスを特異的に抑制することを見出し、これを用いてネクローシスのメカニズム解明を進めました。また、IM誘導体を用いた評価系により、ネクローシス様の細胞死を選択的に誘導できるネクローシス誘導剤NT(NecroTrigger)化合物の開発に成功しました。
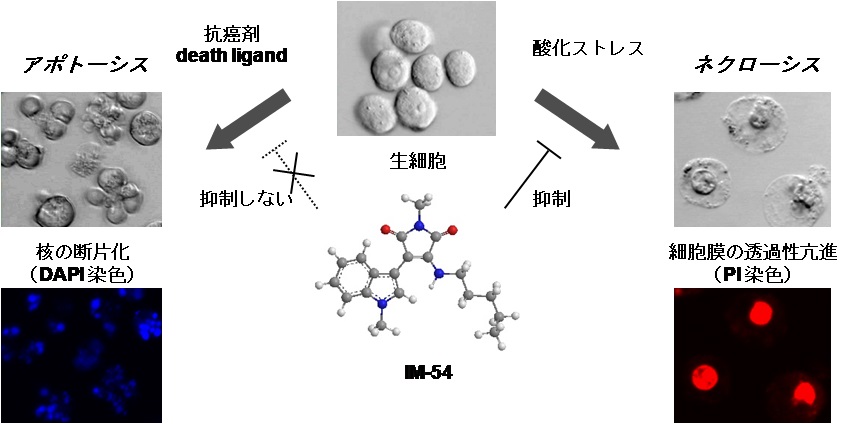
- Mikiko Sodeoka, Kosuke Dodo. Development of Selective Inhibitors of Necrosis. Chemical Record, 10, 308-314 (2010).
生細胞反応グループ
アルキンで修飾された生体分子の捕捉を目指し、コバルト・カルボニル錯体を用いる精製法の開発を行いました。種々検討を行い、水中でアルキン修飾分子と錯体形成が可能な固相担持コバルト・カルボニル錯体の開発に成功しました。また、コバルト錯体が形成された時だけ酸で切断可能なリンカーを挟み、アルキン修飾分子をアミン体として溶出させることも検討しました。その結果、アルキン修飾ジペプチドを10種のペプチドとの混合物中から精製・濃縮することに成功しました。
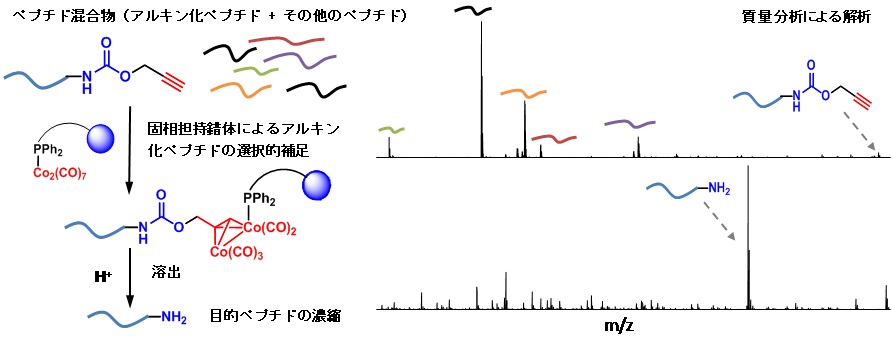
- Hiromichi Egami, Shinji Kamisuki, Kosuke Dodo, Miwako Asanuma, Yoshitaka Hamashima, Mikiko Sodeoka. Catch & release of alkyne-tagged molecules in water by polymer-supported cobalt complex. Org. Biomol. Chem., 9, 7667-7670 (2011).
- Ayako Miyazaki, Miwako Asanuma, Kosuke Dodo, Hiromichi Egami, and Mikiko Sodeoka. A Catch and Release Protocol of Alkyne-Tagged Molecules Based on a Resin-Bound Cobalt Complex for Peptide Enrichment in Aqueous Media. Chem. Eur. J. 20, 8116-8128 (2014).
さらに、リジン残基特異的に反応して蛍光を発するO-NBDユニットを用いたturn-ON型アフィニティーラベル化法の開発に成功しました。この方法を用いて、ミトコンドリア膜タンパク質複合体の解析を行うことができました。
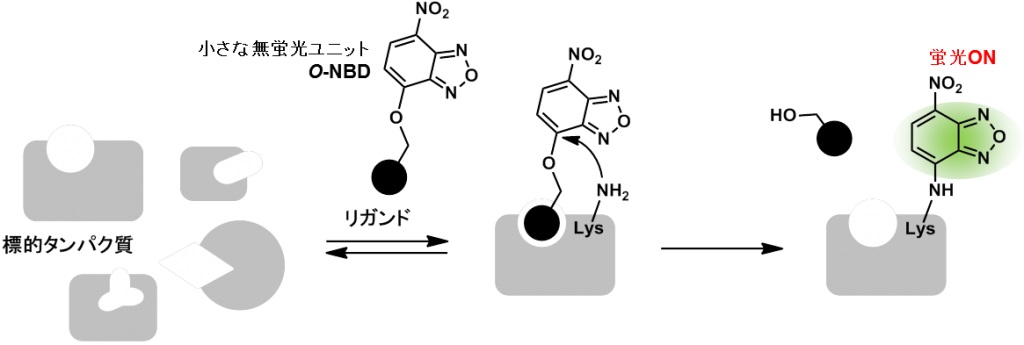
- Takao Yamaguchi, Miwako Asanuma, Shuichi Nakanishi, Yohei Saito, Masateru Okazaki Kosuke Dodo, Mikiko Sodeoka, Turn-ON fluorescent affinity labeling using a small bifunctional O-nitrobenzoxadiazole unit. Chem. Sci., 5, 1021-1029 (2014).
生細胞解析グループ
低分子化合物の細胞内局在を調べる手法として、分子の振動状態を反映するラマン散乱光を用いたイメージングを検討しました。種々の官能基の中で、アルキンは極めて小さな分子でありながら細胞内分子が持たない特徴的かつ強いラマン散乱を示すことが知られています。そこで、これをタグ(標識)としてラマン顕微鏡でイメージングすることを目標に研究を行いました。
5-ethynyl-2’-deoxyuridine (EdU)は、DNAを構成するdeoxythymidine (dT)のミミックであり、核内のDNAに取り込まれることが知られています。このEdUで処理した細胞のラマン顕微鏡観察を検討したところ、EdUのアルキンに由来するラマンシグナルの検出に成功し、さらにはEdUが経時的に核に取り込まれる様子を生細胞で観察することに成功しました。また、様々なアルキン分子のラマンシグナルを比較することで、どのようなアルキンをタグとすればよいかを明らかにしました。さらに、ユビキノンにEdUと異なるラマンシグナルを持つアルキンタグを導入し、EdUと同時にイメージングすることにも成功しました。加えて、人工脂質ラフト膜におけるスフィンゴミエリンの分布のイメージングにも成功しました。
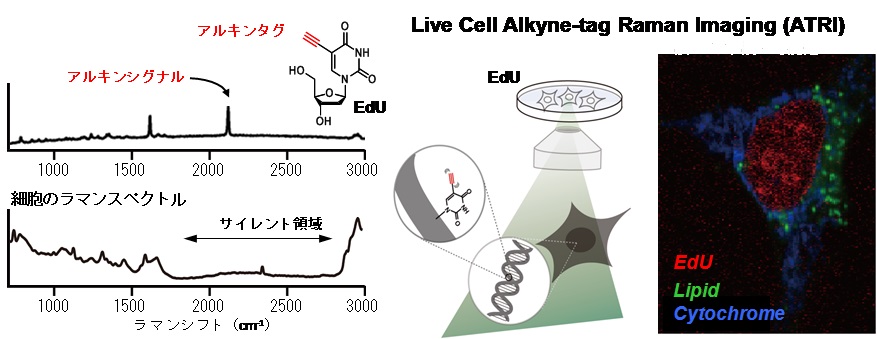
- Hiroyuki Yamakoshi, Kosuke Dodo, Masaya Okada, Jun Ando, Almar Palonpon, Katsumasa Fujita, Satoshi Kawata, Mikiko Sodeoka. Imaging of EdU, an Alkyne-tagged Cell Proliferation Probe, by Raman Microscopy. J. Am. Chem. Soc., 133, 6102-6105 (2011).
- Hiroyuki Yamakoshi, Kosuke Dodo, Almar Palonpon, Jun Ando, Katsumasa Fujita, Satoshi Kawata, and Mikiko Sodeoka, Alkyne-tag Raman imaging for visualization of mobile small molecules in live cells. J. Am. Chem. Soc., 134, 20681-20689 (2012).
- Almar F. Palonpon, Jun Ando, Hiroyuki Yamakoshi, Kosuke Dodo, Mikiko Sodeoka, Satoshi Kawata, and Katsumasa Fujita. Raman and SERS Microscopy for molecular imaging of live cells. Nature Protocols, 8, 677-692 (2013).
- Hiroyuki Yamakoshi, Almar F Palonpon, Kosuke Dodo, Jun Ando, Satoshi Kawata, Katsumasa Fujita, and Mikiko Sodeoka. Simultaneous imaging of protonated and deprotonated carbonylcyanide p-trifluoromethoxyphenylhydrazone in live cells by Raman microscopy. Chem. Commun., 50, 1341-1343 (2014).
- Jun Ando, Masanao Kinoshita, Jin Cui, Hiroyuki Yamakoshi, Kosuke Dodo, Katsumasa Fujita, Michio Murata, Mikiko Sodeoka. Sphingomyelin distribution in lipid rafts of artificial monolayer membranes visualized by Raman microscopy. Proc. Nat. Acad. Sci., 112, 4558-4563 (2015).