
研究総括 東山 哲也
(名古屋大学 トランスフォーマティブ生命分子研究所 教授)
研究期間:2010年10月~2016年3月
特別重点期間:2016年4月~2017年3月
グラント番号:JPMJER1004
多細胞生物では、個々の細胞が、近距離あるいは遠距離にある他の細胞とコミュニケーションをとりながら自らの位置や機能に関する情報を把握し、生物個体としてのバランスをとっています。このように細胞が自身の役割を知り、集団に対して自立的な秩序をもたらすような個と全体を調和する細胞間コミュニケーションをホロニックコミュニケーションと呼びます。本プロジェクトでは、中枢制御系を持たず、多くの高次生命現象が細胞間コミュニケーションで制御される植物をモデルに、生殖の過程を中心にホロニックコミュニケーションの解明を目指しました。このための独自のアプローチとして、ナノ工学、光技術、シングルセルオミクスを専門とする3グループによる真の異分野融合を進めました。その結果、「顕微鏡下で自由自在に」を基本方針に、ライブセル生物学分野の確立が進みました。さらに、合成化学を専門とする研究者達との共同研究も進展することで、植物の様々な細胞・組織・器官間コミュニケーションの仕組みや、それに関わる分子群の解明が飛躍的に進みました。
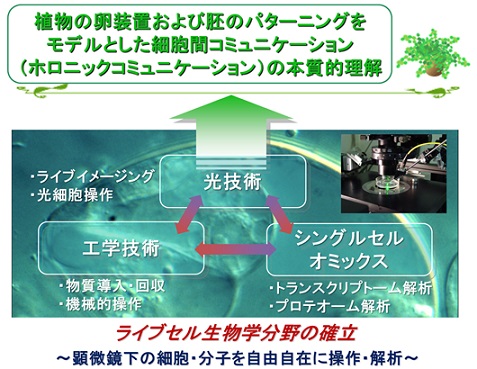
研究成果
ナノ工学グループ
MEMS技術によるマイクロ流体デバイスを駆使することで、植物の個体、組織、細胞、分子の各階層を縦断的に自在に操作・計測できる技術を確立し、ホロニックコミュニケーションの本質的理解を目指しました。様々なマイクロ流体デバイスを構築することで、花粉管ガイダンスにおける短距離・長距離ガイダンス分子の定量的な評価に成功しました。また、植物の初期胚を安定的に培養しながら長期間にわたってライブイメージング可能なデバイスを開発し、初期胚発生過程の研究を加速するための技術基盤を確立しました。
例えば、長年その存在が予測されてきた長距離ガイダンス分子について、図に示すように明確にその存在を示し、さらに長距離ガイダンス分子CALLの同定に成功しました。
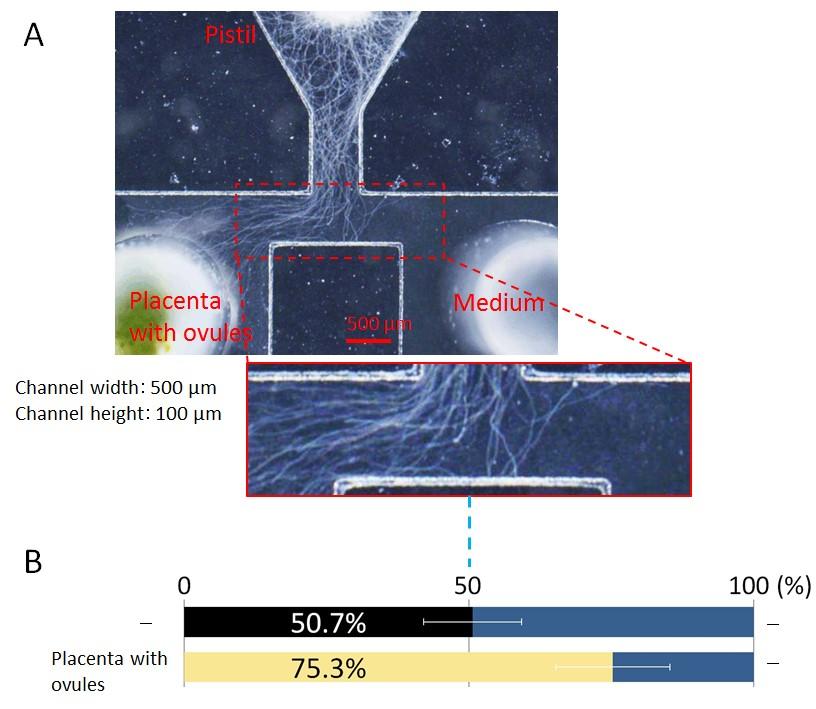
- A microfluidic device for quantitative analysis of chemoattraction in plants. M. Horade, M.M. Kanaoka, M. Kuzuya, T. Higashiyama, N. Kaji. RSC Adv., 2013, 3, 22301, 2013
- Fabrication of microcage arrays to fix plant ovules for long-term live imaging and observation. J.H. Park, D. Kurihara, T. Higashiyama, H.Arata. Sensor. Actuat. B-Chem., 191, 178-185, 2014
- Growth assay of individual pollen tubes arrayed by microchannel device. M. Horade, N. Yanagisawa, Y. Mizuta, T. Higashiyama, H. Arata. Microelectron. Eng., 118, 25-28, 2014
- Chemotaxis assay of plant-parasitic nematodes on a gel-filled microchannel device. H. Hida, H. Nishiyama, S. Sawa, T. Higashiyama, H. Arata. Sensor. Actuat. B-Chem., 221, 1483-1491, 2015
- Quantification of pollen tube attraction in response to guidance by female gametophyte tissue using artificial microscale pathway. Y. Sato, N. Sugimoto, T. Higashiyama, H. Arata. J. Biosci. Bioeng., 120, 697-700, 2015
光技術グループ
本グループは、植物の生殖過程および胚発生過程を、顕微鏡下において生きたまま可視化・観察する系の開発、そして光操作によって時空間特異的に遺伝子発現・細胞活性を制御する高精度な顕微鏡技術を確立・駆使することによって、長時間にわたる卵装置形成、花粉管ガイダンス、重複受精、胚発生過程における、ホロニックコミュニケーションのメカニズム解明を目指し、解析を行いました。以下に代表的な成果を記します。
・ナノ工学グループと共同で開発したマイクロデバイスを駆使しながら、卵装置形成、花粉管ガイダンス、重複受精、胚発生過程をリアルタイムに観察・解析できる系を確立しました。
・近赤外超短パルスレーザーを用いた光顕微操作によって、リアルタイムでの単一細胞の破壊を達成し、卵装置形成・胚発生過程において、細胞間コミュニケーションを介した細胞運命転換の様子を明らかにしました。
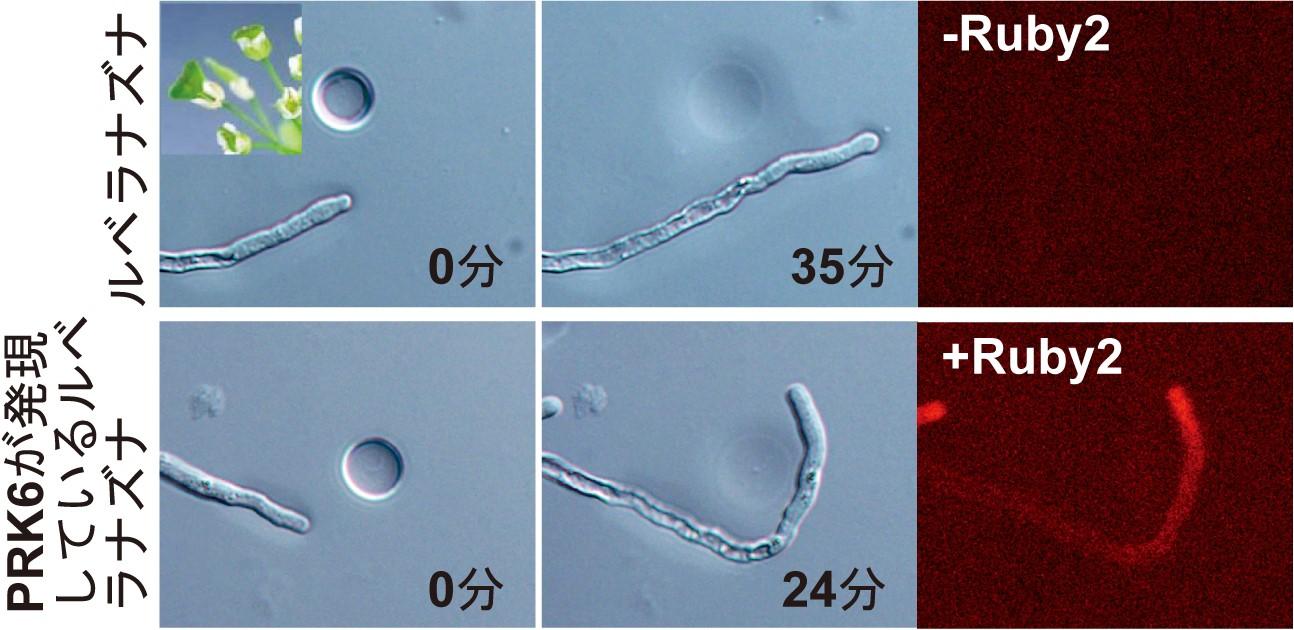
・花粉管ガイダンスにおいて、誘引物質LUREと受容体PRK6のライブイメージングに成功し、LUREに応答した受容体の挙動を明らかにし、雌雄間コミュニケーションを捉えました。また、花粉管を受精可能に成熟させる雌しべ由来の糖分子AMORおよび活性重要な糖構造の同定、花粉管誘引停止に関わる機構としては植物において新たな細胞融合現象を発見しました。今後、独自に開発した高効率なゲノム編集の分子ツール、pKAMA-ITACHIベクターによりさらなる解析が進むと期待されます。
・重複受精過程において、受精に関わる各細胞における特徴的なカルシウム濃度変化を捉えることに成功し、各細胞間のコミュニケーションによって多精拒否を達成している足がかりをつかみました。
・植物を丸ごと透明化し、解剖することなく、複雑な内部構造を1細胞レベルで蛍光観察ができる技術ClearSeeを開発し、市販化もしました。
- Hamamura Y., Nishimaki M., Takeuchi H., Geitmann A., Kurihara D., Higashiyama T. (2014) Live imaging of calcium spikes during double fertilization in Arabidopsis. Nature Commun., 5: 4722
- Maruyama D., Völz R., Takeuchi H., Mori T., Igawa T., Kurihara D., Kawashima T., Ueda M., Ito M., Umeda M., Nishikawa S., Groß-Hardt R., Higashiyama T. (2015) Rapid elimination of the persistent synergid through a cell fusion mechanism. Cell, 161: 907-918.
- Gooh K., Ueda M., Aruga K., Park J., Arata H., Higashiyama T., Kurihara D.(2015) Live-cell imaging and optical manipulation of Arabidopsis early embryogenesis. Dev. Cell, 34: 242-251.
- Kurihara D., Mizuta Y., Sato Y., Higashiyama T.(2015) ClearSee: a rapid optical clearing reagent for whole-plant fluorescence imaging. Development, 142: 4168-4179.
- Takeuchi H, Higashiyama T.(2016) Tip-localized receptors control pollen tube growth and LURE sensing in Arabidopsis. Nature, 531: 245-248.
シングルセルオミクスグループ
次世代型シーケンサーおよびMALDI-TOF/MSを使用してシングルセルタイプを解析するオミクス技術の開発を行いました。トレニアのゲノム解析に加え、配偶体からmRNAを抽出し、その遺伝子発現プロファイルを解析することに成功しました。一連の解析は、独自に見出したホロニックコミュニケーションに関する現象について、鍵分子群の同定を達成するのに大きく貢献しました。AMOR、CALL、PRK6およびその周辺分子のトレニアならびにシロイヌナズナでの解析が飛躍的に進みました。受精回復機構や、花粉管の内容物が未受精胚珠の発達を促すPOEM現象の発見にもつながりました。
様々な植物のトランスクリプトームをモデル・非モデル生物を問わずに解析できるプラットフォームPoTHoSを開発しました。
次世代型シーケンサーを植物科学へ応用し、研究を加速するための技術開発を行いました。
変異株の原因遺伝子を探すためのプラットフォームMitsucalを開発しました。
これまで同じ科に属する植物の間だけで行うことができると考えられていた接ぎ木を異科間で可能にする技術を開発しました(特許2件)。これらの方法は育種や植物の研究にブレークスルーをもたらすものと期待されています。

- Kasahara D.R., Maruyama D., Hamamura Y., Sakakibara T., Twell D., Higashiyama T. (2012) Fertilization Recovery after Defective Sperm Cell Release in Arabidopsis. Curr. Biol., 22, 1084-1089.
- Okuda S, Suzuki T, Mori H, Kanaoka M M, Sasaki N, Higashiyama T. (2013) Acquisition of LURE-Binding Activity at the Pollen Tube Tip of Torenia fournieri. Mol. Plant, 6, 1074-1090
- Tsukagoshi H., Suzuki T., Nishikawa K., Agarie S., Ishiguro S., Higashiyama T. (2014) RNA-seq analysis of the response of the halophyte, Mesembryanthemum crystallinum (ice plant) to high salinity. PLoS One 10(2):e0118339.
- Notaguchi M., Higashiyama T., Suzuki T. (2015) Identification of mRNAs that Move Over Long Distances Using an RNA-Seq Analysis of Arabidopsis/Nicotiana benthamiana Heterografts. Plant Cell Physiol., 56, 311-321
- Kasahara R., Notaguchi M., Nagahara S., Suzuki T., Susaki D., Honma Y., Maruyama D., Higashiyama T. (2016) Pollen tube contents initiate ovule enlargement and enhance seed coat development without fertilization. Science Advances 2, e1600554.