- JST トップ
- /
- 戦略的創造研究推進事業
- /
 ERATO
ERATO- /
- 研究領域の紹介/
- 終了領域/
- 野村集団微生物制御プロジェクト
野村集団微生物制御プロジェクト

研究総括 野村 暢彦
(筑波大学 生命環境系 教授)
研究期間:2015年10月~2022年3月
※本プロジェクトは、新型コロナウイルス感染症に伴う研究遅延対応策として、2022年3月まで研究期間を延長しました。
グラント番号:JPMJER1502
本プロジェクトでは、微生物集団における個々の微生物と集団全体を理解し、さらには微生物集団と他生物との相互作用を明らかにすることを目的とした。これらを実現するために、1細胞から集団全体、さらには集団が付着している気質面の状態までを同時に解析できるマイクロ流体デバイスや高度なイメージング技術の開発を進めながら、プロジェクトを推進した。得られた知見をもとにして、微生物集団を対象とした新たな微生物制御の開発にも取り組んだ。その結果、全体的な進展として、1細胞レベルの現象がどのように集団全体に波及するかについての理解が深まった。とりわけ、集団形成に必須な細胞外マトリクスに着目することで、1細胞と集団形成を結びつけて理解することができ、集団微生物学を発展させる根本的な知見が得られた。集団形成の分子基盤を解明したことにより、それをターゲットとした、新たな微生物集団制御法も提案された。また、細菌集団と他の生物との相互作用に関して、細菌とその共生や宿主の両面から研究を進めることで、新しい集団微生物学の展開が生まれた。
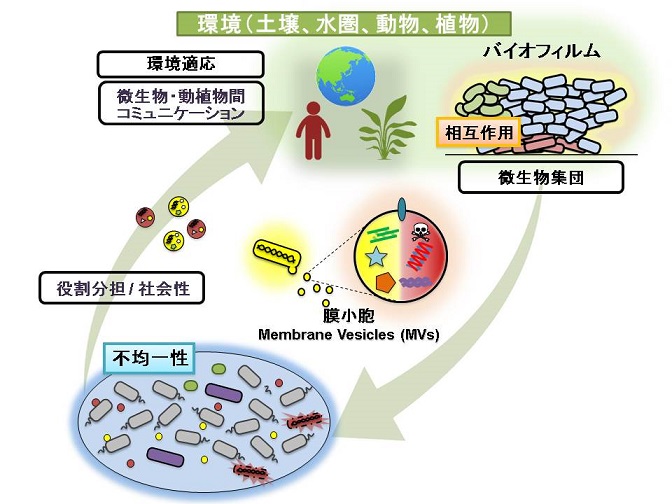
研究グループ
・微生物間相互作用グループ
・微生物・動植物相互作用グループ
・不均一性グループ
・デバイス開発・イメージンググループ
・ゲノム生化学グループ
・シミュレーショングループ
研究成果
細菌の細胞外膜小胞の役割と形成機構の解明
これまで膜小胞(MVs)は細胞が生きたまま放出されるとされてきた。これに対し、細胞死を伴いながら膜小胞を形成するメカニズムを解明した。(Nature communications 2016, Nature Communications 2017, iScience 2021)さらに、構造が異なるグラム陰性菌とグラム陽性菌においても共通して細胞壁の分解がMV形成を誘発することを明らかにした。これらの成果より、MVが形成される経路に応じてその種類や機能が異なってくることを提唱した。 (Nature Reviews Microbiology 2019)また、微生物間コミュニケーションにおいてMVが疎水性のシグナル化合物を濃縮して伝達する新たな機構を見出した。(ISME J 2017)
- Nagakubo, T., Tahara YO, Miyata M, *Nomura N, *Toyofuku M (2021) Mycolic acid-containing bacteria trigger distinct types of membrane vesicles through different routes. iScience 24:102015.
- Toyofuku M, Nomura N, *Eberl L. Types and origins of bacterial membrane vesicles. (2019) Nat Rev Microbiol 17:13-24.
- *Toyofuku M, Cárcamo-Oyarce G, Yamamoto T, Eisenstein F, Hsiao C, Kurosawa M, Gademann K, *Pilhofer M, Nomura N, and *Eberl L. Prophage-triggered membrane vesicle formation through peptidoglycan damage in Bacillus subtilis. Nature Communications, 8:481, 2017.
- Toyofuku M, Morinaga K, Hashimoto Y, Uhl J, Shimamura H, Inaba H, Schmitt-Kopplin P, Eberl L, *Nomura N. Membrane vesicle-mediated bacterial communication. The ISME Journal, 11:1504-1509, 2017.
- †Turnbull L, †*Toyofuku M, Hynen AL, Kurosawa M, Pessi G, Petty NK, Osvath SR, Cárcamo-Oyarce G, Gloag ES, Shimoni R, Omasits U, Ito S, Yap X, Monahan LG, Cavaliere R, Ahrens CH, Charles IG, Nomura N, *Eberl L and *Whitchurch CB. Explosive cell lysis is a novel mechanism for the biogenesis of membrane vesicles and biofilms. Nature Communications, 7:11220, 2016
非破壊細胞評価技術の開発
シミュレーショングループでは、多細胞微生物および単細胞微生物の集合体の中での細胞のヘテロ性と機能分化を定量的に解析するために、1細胞の性質を非破壊的に分析できる新たな細胞分析技術CRIF (confocal reflection microscopy-assisted single-cell innate fluorescence analysis) の開発を行った。CRIFを用いた研究から、一見均一に見える細胞集団内にも想像以上の不均一性(細胞毎の個性)が存在することや、1細胞レベル解析から得られるビッグデータを生かして効率的な機械学習を行い、高性能な細胞タイプ判別モデルが構築できることが分かってきた。
- Okano C, Takabe K, Hirayama T, Nomura N, Yawata Y. Three-dimensional morphology of bacterial community developed on the index-matched materials. Scientific Reports 11:19508. 2021.
- Hirayama T, Takabe K, Kiyokawa T, Nomura N, Yawata Y, 2020, Reconstruction of Single-Cell Innate Fluorescence Signature by Confocal Microscopy, Journal of Visualised Experiments (159), e61120, doi:10.3791/61120
- Yawata Y, Kiyokawa T, Kawamura Y, Hirayama T, Takabe K, Nomura N. Intra- and interspecies variability of single-cell innate fluorescence signature of microbial cell. Appl Environ Microbiol 85:e00608-19. 2019.
糸状菌の菌糸成長と細菌との相互作用
糸状菌の有用性と病原性を特徴付ける菌糸の伸びる仕組みを、超解像顕微鏡注を含む蛍光イメージング技術により明らかにした。 (PNAS 2017, Sci Adv 2018)
- Takeshita N, Evangelinos M, Zhou L, Serizawa T, Somera-Fajardo RA, Lu L, Takaya N, Nienhaus GU, Fischer R. Pulses of Ca2+ coordinate actin assembly and exocytosis for stepwise cell extension. Proc Natl Acad Sci U S A. 114, 5701-5706, 2017
- Zhou L, Evangelinos M, Wernet V, Eckert AF, Ishitsuka Y, Fischer R, Nienhaus GU, Takeshita N. Superresolution and pulse-chase imaging reveal the role of vesicle transport in polar growth of fungal cells. Science Adv. 4, e1701798, 2018
- Kiss E, Hegedüs B, Virágh M, Varga T, Merényi Z, Kószó T, Bálint B, Prasanna AN, Krizsán K, Kocsubé S, Riquelme M, Takeshita N, Nagy LG. Comparative genomics reveals the origin of fungal hyphae and multicellularity. Nature Commun. 10, 4080, 2019
- Abeysinghe G, Kuchira M, Kudo G, Masuo S, Ninomiya A, Takahashi K, Utada AS, Hagiwara D, Nomura N, Takaya N, Obana N, Takeshita N. Fungal mycelia and bacterial thiamine establish a mutualistic growth mechanism. Life Sci Alliance. 3, e202000878, 2020
マイクロ流体デバイスを用いたバイオフィルム形成の分析および制御
デバイスイメージンググループでは、工学からのツールとソフトマター物理学からのアプローチを高解像度イメージングと組み合わせ、様々な条件下における環境バクテリアのバイオフィルム形成の分析および制御を行った。
2次元マイクロ流体: 細菌を長期閉じ込めイメージングを可能にする擬似2次元のマイクロ流体チャンバーを設計し製作した。高解像度のイメージングにより、主要な虫歯菌であるStreptococcus mutansの細胞外シグナルペプチド(competence-stimulating peptide, CSP)とバイオフィルム間eDNA産生の関係を明らかにした。(Nagasawa, 2020)
また、このデバイスを用い、糸状菌Leptothrix cholodniiがナノフィブリルを介して初期接着を開始することを示した。さらに、付着後、個々のフィラメントの力学を解析し、障害物を回避して逆走する能力により、障害物に遭遇しても継続的に伸長する能力を示した。
(Kunoh, 2020)
また、様々な栄養条件におけるフィラメント形成をテストすることで、排水処理施設でのバルキングにつながるLeptothrixの成長を制御する方法を見出した。(Kunoh, 2021)
バイオサーファクタントを介したバイオフィルムの破壊:マイクロ流体工学を用いて平行試験流路を設計し、バイオサーファクタントのソホロリピッド(SL)が成熟緑膿菌のバイオフィルム破壊に与える影響を比較した。その結果、SLは緑膿菌のバイオフィルムを表面から剥離させると同時に、細胞外マトリックスの分解を誘導することで、バイオフィルムを破壊できることを見出した。また、SDSとの相乗効果により、サーファクタントの濃度を下げても同等の効果が得られることを示した 。(Nguyen, 2020)
油分解菌のc-di-GMP分泌: 炭化水素分解菌Alcanivorax borkumensis SK2のコロニー形態の違いが点変異に由来し、c-di-GMPの増加やバイオフィルムの形成につながることを見出した。
ビブリオコレラ菌の表面付着: べん毛と鞭毛を標識した変異体を用いて、世界で初めてビブリオコレラの表面付着の初期段階を画像化し、解析した。
- Zhang W, Luo M, Feng C, Liu H, Zhang H, *Bennett RR, *Utada AS, *Liu Z, *Zhao K (2021) Crash landing of Vibrio cholerae by MSHA pili-assisted braking and anchoring in a viscous environment. eLife 10: e60655.
- *Kunoh T, Yamamoto T, Sugimoto S, Ono E, *Nomura N, *Utada AS. (2021) Leptothrix cholodnii response to nutrient limitation. Front Microbiol 12: 691563.
- Abeysinghe G, Kuchira, M, Kudo G, Masuo S, Ninomiya A, Takahashi K, Utada AS, Hagiwara D, Nomura, N Takaya N, Obana N, *Takeshita N (2020) Fungal mycelia and bacterial thiamine establish a mutualistic growth mechanism. Life Sci Alliance 3: e202000878.
- Nagasawa R, Yamamoto T, Utada AS, Nomura N, Obana N (2020) Competence-Stimulating-Peptide-Dependent localized cell death and extracellular DNA production in Streptococcus mutans biofilms. Appl Environ Microbiol 86: e02080-20.
- Nguyen BVG, Nagakubo T, Toyofuku M, *Nomura N, *Utada AS (2020) Synergy between sophorolipid biosurfactant and SDS increases the efficiency of P. aeruginosa biofilm disruption. Langmuir 36: 6411.
- *Kunoh T, Morinaga K, Sugimoto S, Miyazaki S, Toyofuku M, Iwasaki K, *Nomura N, *Utada AS (2020) Polyfunctional nanofibril appendages mediate attachment, filamentation, and filament adaptability in Leptothrix cholodnii. ACS Nano 14: 5288-5297.
- Prasad M, Obana N, Sakai K, Nagakubo T, Miyazaki S, Toyofuku M, Fattaccioli J, *Nomura N, *Utada AS (2019) Point mutations in Alcanivorax borkumensis SK2 type strain leads to increased levels of c-di-GMP and biofilm formation. Microbes Environ 34: 104-107.
環境因子に応答したバイオフィルム不均一性の制御機構
モノクローナルな細胞集団から成るバイオフィルムにおいても、その内部には多様な表現型を有する細胞亜集団が出現することが知られている。我々のグループでは、共焦点レーザー顕微鏡技術を駆使して、バイオフィルム中の遺伝子発現の空間的不均一性形成機構を明らかにした。 また、口腔細菌における細胞間コミュニケーションを介した細胞死の不均一性形成がバイオフィルム形成に寄与することを明らかにした。
- Obana N, Nakamura K, Nomura N. (2020) Temperature-regulated heterogeneous extracellular matrix gene expression defines biofilm morphology in Clostridium perfringens. NPJ Biofilms Microbiomes. 6(1):29.
- Nagasawa R, Yamamoto T, Utada AS, Nomura N, Obana N. (2020) Competence-Stimulating-Peptide-Dependent Localized Cell Death and Extracellular DNA Production in Streptococcus mutans Biofilms. Appl Environ Microbiol. 86(23):e02080-20.
- Abe K, Toyofuku M, Nomura N, Obana N. (2021) Autolysis-mediated membrane vesicle formation in Bacillus subtilis. Environ Microbiol. (5):2632-2647.
植物免疫の時空間的制御機構
植物免疫は、これまでの数多くの遺伝学的・生化学的解析により、相互拮抗関係にあるサリチル酸(SA)やジャスモン酸(JA)といった植物ホルモンシグナル経路間の複雑なクロストークによって制御されていることが明らかとされてきた。しかし、これらシグナル経路それぞれの時空間的な動態に関してはほとんどわかっていなかった。そこで、我々は植物の免疫関係遺伝子のプロモーター活性を土植え植物の中で可視化できるライブイメージングシステムを構築し、それらの時空間的活性化パターンを捉えることに成功した。(Betsuyaku et al., 2019)
この系を用いて、強力な植物免疫の一つであるエフェクター誘導免疫を起こした場合、上述のSAおよびJAシグナル経路が感染部位の空間的に異なる領域で特異的に活性化することを見出した。
(Betsuyaku et al., 2018)
また、局所的な一次感染は、植物個体に全身的な免疫を誘導することが知られており、全身獲得抵抗性(SAR)と呼ばれている。これもまた時空間的に制御された植物免疫の一種である。我々は、土壌へのSA灌注処理が、地上部組織でSARレギュレーターとして知られているWRKY33を活性化することを見出した。我々の遺伝学的な解析により、分泌性ペプチドをコードするCLE3の根部に限定された発現が、地下部SA処理による地上部でのWRKY33活性化に必要であることを見出し、CLE3ペプチドが、根部由来のSAR誘導ペプチドシグナルであることを強く示唆した。(Ma et al., 2022)
- Betsuyaku S, Katou S, Takebayashi Y, Sakakibara H, Nomura N, Fukuda H. (2018) Salicylic Acid and Jasmonic Acid Pathways are Activated in Spatially Different Domains Around the Infection Site During Effector-Triggered Immunity in Arabidopsis thaliana. Plant Cell Physiol. 59(1):8-16.
- Betsuyaku S, Nomura N, Fukuda H. (2019) A Versatile Method for Mounting Arabidopsis Leaves for Intravital Time-lapse Imaging. J Vis Exp. 144.e5914
- Ma D, Endo S, Betsuyaku E, Fujiwara T, Betsuyaku S, Fukuda H. (2022) Root-specific CLE3 expression is required for WRKY33 activation in Arabidopsis shoots. Plant Mol Biol. 3:225-239.
植物病原細菌の病原性ターゲットが植物の気孔防御であることの解明
細菌などの植物病原体は宿主植物に対してエフェクターなどの様々な病原性関連分子を分泌することが知られてる。モデル植物のみならず、農業上重要な農作物をも含んだ様々な植物-病原細菌系を用いて、我々は、植物の持つ気孔防御システムが、宿主範囲を超えた数多くの植物病原細菌の共通した病原性ターゲットであることを明らかとした。さらに、これら知見を生かして、植物の気孔免疫を標的として活性化させることで細菌による植物病害を防除する手法を開発した。
- Ishiga Y, Ishiga T, Ichinose Y, Mysore KS. (2017) Pseudomonas syringae Flood-inoculation Method in Arabidopsis. Bio Protoc. 7(2):e2106.
- AlgU contributes to the virulence of Pseudomonas syringae pv. tomato DC3000 by regulating production of the phytotoxin coronatine
- Ishiga T, Ishiga Y, Betsuyaku S, Nomura N. (2018) AlgU contributes to the virulence of Pseudomonas syringae pv. tomato DC3000 by regulating production of the phytotoxin coronatine. JGPP. 84 (3), 189-201
- Sakata N, Ishiga T, Saito H, Nguyen VT, Ishiga Y. (2019) Transposon mutagenesis reveals Pseudomonas cannabina pv. alisalensis optimizes its virulence factors for pathogenicity on different hosts. PeerJ. 7:e7698.
- Ishiga T, Sakata N, Nguyen VT, Ishiga Y. (2020) Flood inoculation of seedlings on culture medium to study interactions between Pseudomonas syringae pv. actinidiae and kiwifruit. J Gen Plant Pathol.86(4):257-265.
- Hirose K, Ishiga Y, Fujikawa T. (2020) Phytotoxin synthesis genes and type III effector genes of Pseudomonas syringae pv. actinidiae biovar 6 are regulated by culture conditions. PeerJ. 8:e9697.
- Nguyen VT, Sakata N, Usuki G, Ishiga T, Hashimoto Y, Ishiga Y. (2021) Multiple virulence factors regulated by AlgU contribute to the pathogenicity of Pseudomonas savastanoi pv. glycinea in soybean.PeerJ. 9:e12405.
- Sakata N, Ishiga T, Ishiga Y. (2021) Pseudmonas cannabina pv. alisalensis TrpA Is Required for Virulence in Multiple Host Plants. Front Microbiol. 12:659734.
- Sakata N, Ishiga T, Masuo S, Hashimoto Y, Ishiga Y. (2021) Coronatine Contributes to Pseudomonas cannabina pv. alisalensis Virulence by Overcoming Both Stomatal and Apoplastic Defenses in Dicot and Monocot Plants. Mol Plant Microbe Interact. 7:746-757.
- Ishiga T, Iida Y, Sakata N, Ugajin T, Hirata T, Taniguchi S, Hayashi K, Ishiga Y. (2020) Acibenzolar-S-methyl activates stomatal-based defense against Pseudomonas cannabina pv. alisalensis in cabbage. J Gen Plant Pathol. 86 (1), 48-54
- Sakata N, Ishiga T, Taniguchi S, Ishiga Y. (2020) Acibenzolar-S-Methyl Activates Stomatal-Based Defense Systemically in Japanese Radish. Front Plant Sci. 11:565745.
- Ishiga T, Sakata N, Ugajin T, Ishiga Y (2021) Acibenzolar-S-methyl and probenazole activate stomatal-based defense at different times to control bacterial blight of cabbage. J Gen Plant Pathol. 87 (1), 30-34
- Sakata N, Aoyagi T, Ishiga T, Ishiga Y. (2021) Acibenzolar-S-methyl efficacy against bacterial brown stripe caused by Acidovorax avenae subsp. avenae in creeping bentgrass J Gen Plant Pathol. 87 (6), 387-393
複合微生物集団を構成する未知微生物の培養化と新生物機能の解明
複合微生物集団を構成する難培養性未知微生物の純粋分離に成功し、ゲノム解析・生理生化学的解析にもとづいて新たな生物機能の解明に至った。特に、世界中の地下環境で優先していることが知られていながら、永きにわたり純粋培養がなされてこなかった「門」レベルで新規な地下細菌の純粋分離に成功した。さらに驚くべきことに、本細菌が、本来ヒトや植物などの真核生物の形質とされる「ゲノムを包む膜」をもつということを世界に先駆けて明らかにした。(Katayama et al., Nature Communication 2020)
また別の深部地下環境からFirmicutes門の目レベルで新規な細菌の純粋分離にも成功し、培養実験とゲノム解析により、本細菌がメタン生成アーキアと共生系を築き、地下の根源有機物を分解してメタン生成する重要なプロセスに関与することを明らかにした。(Sakamoto et al., Syst. Appl. Microbiol. 2021)
次に、植物-微生物共生系を構成する未知微生物の機能解明にも取り組み、培養頻度の非常に低い門として知られるAcidobacteria門、Armatimonadetes門、Verrucomicrobia門に属する新規細菌の純粋分離に成功するとともに、それらの植物成長促進能を明らかにした。
(Yoneda et al., Microorganisms 2021)
さらに、環境中に広く棲息する多様な抗生物質耐性菌を培養化し、それらが微生物コミュニケーションを遮断する(quorum quenching)能力があることを明らかにした。
(Kusada et al., Appl. Environ. Microbiol. 2017,
Kusada et al., Frontiers in Microbiol. 2019)
またゲノムワイドな解析により、不均一環境における病原菌の進化動態に及ぼす種間相互作用の影響を明らかにするとともに
(Yamamoto et al., Microorgansims 2021)
未知の複合微生物集団の一つである地下圏環境を対象として、そこに生息するレアバイオスフィア(希少微生物群)の次世代シークエンス解析を実施し、その群集構造・活性とそれを決定づける環境要因との関連性を明らかにした。
(Yamamoto et al., Sci. Rep., 2019)
- Kusada H, Tamaki H, Kamagata Y, Hanada S, Kimura N (2017) A Novel Quorum-Quenching N-Acylhomoserine Lactone Acylase from Acidovorax sp. Strain MR-S7 Mediates Antibiotic Resistance, Appl. Environ. Microbiol. 83: e00080-17.
- Kusada H, Zhang Y, Tamaki H(CA), Kimura N, Kamagata Y (2019) Novel N-acyl homoserine lactone-degrading bacteria isolated from penicillin-contaminated environments and their quorum-quenching activities, Frontiers in Microbiol. 10:455.
- Yamamoto K, Hackley CK, Kelly RW, Panno VS, Sekiguchi Y, Sanford RA, Liu WT, Kamagata Y, Tamaki H (2019) Diversity and geochemical community assembly processes of the living rare biosphere in a sand-and-gravel aquifer ecosystem in the Midwestern United States, Sci. Rep. 9:1-11.
- Katayama T, Nobu MK, Kusada H, Meng XY, Hosogi N, Uematsu K, Yoshioka H, Kamagata Y, Tamaki H (2020) Isolation of Atribacteria reveals a unique cell membrane structure, Nature Communications, 11: 1-9.
- Sakamoto S, Nobu MK, Mayumi D, Tamazawa S, Kusada H, Yonebayashi H, Iwama, H, Ikarashi M, Wakayama T, Maeda H, Sakata S, Tamura T, Nomura N, Kamagata, Y, Tamaki H (2021) Koleobacter methoxysyntrophicus gen. nov., sp. nov., a novel anaerobic bacterium isolated from deep subsurface oil field and proposal of Koleobacteraceae fam. nov. and Koleobacterales ord. nov. within the class Clostridia of the phylum Firmicutes, Syst Appl Microiol, 44: 126154.
- Yamamoto K, Kusada H, Kamagata Y, Tamaki H (2021) Parallel Evolution of Enhanced Biofilm Formation and Phage-Resistance in Pseudomonas aeruginosa during Adaptation Process in Spatially Heterogeneous Environments, Microorganisms 9 (3), 569.
- Yoneda Y, Yamamoto K, Makino A, Tanaka Y, Meng XY, Hashimoto J, Shin-ya K, Satoh N, Fujie M, Toyama T, Mori K, Ike M, Morikawa M, Kamagata Y, Tamaki H (2021) Novel Plant-Associated Acidobacteria Promotes Growth of Common Floating Aquatic Plants, Duckweeds, Microorganisms 9(6), 1133.
ウイルス感染に対する免疫応答
ウイルス感染によって、不均一に複数の細胞死経路が誘導される。
(J Virol. 2018)
その制御分子として、インターフェロンに応答して発現するダイナミン様large GTPaseであるMxAを見出し、MxAが病原体センサーとして機能することでインフラマソームによる炎症が誘導されることを見出した。
(Science Immunol. 2019)
また、感染細胞から細胞外微粒子としてインフラマソームが放出され、細胞間伝播することで、慢性炎症を誘導することも明らかにした。
(JCI Insight, 2021)
- Lee S, Hirohama M, Noguchi M, Nagata K, Kawaguchi A (2018) Influenza A Virus Infection Triggers Pyroptosis and Apoptosis of Respiratory Epithelial Cells through the Type I Interferon Signaling Pathway in a Mutually Exclusive Manner. J. Virol. 92: e00396-18.
- Lee S, Ishitsuka A, Noguchi M, Hirohama M, Fujiyasu Y, Petric PP, Schwemmle M, Staeheli P, Nagata K, Kawaguchi A (2019) Influenza restriction factor MxA functions as inflammasome sensor in the respiratory epithelium. Sci. Immunol. 4: eaau4643
- Lee S, Ishitsuka A, Kuroki T, Lin Y-H, Shibuya A, Hongu T, Funakoshi Y, Kanaho Y, Nagata K, Kawaguchi A (2021) Arf6 exacerbates allergic asthma through cell-to-cell transmission of ASC inflammasomes. JCI Insight 6: e139190.
微生物集団における遺伝型および表現型の不均一性
自然界の微生物集団の中には、遺伝型および表現型双方の多様性が存在するが、それぞれの形成原理とダイナミクスは十分理解されていない。我々は、社会性昆虫の腸内細菌叢において、宿主のカースト特異的に存在する共生細菌や、宿主の系統依存的な腸内細菌叢の多様性を見出した。
(mBio, 2020)(Curr Biol, 2020)
また、クローナルな細菌集団において、遺伝子水平伝播に伴うプログラム細胞死のメカニズムや 、(PLoS Genet, 2019)
長期飢餓環境に対する応答ダイナミクスの不均一性を1細胞レベルの解像度で明らかにした 。(in prep)
- Koto A, Nobu MK, Miyazaki R (2020) Deep sequencing uncovers caste-associated diversity of symbionts in the social ant Camponotus japonicus. mBio 11: e00408-20.
- Ellegaard KM, Suenami S, Miyazaki R, Engel P (2020) Vast differences in strain-level diversity in the gut microbiota of two closely related honey bee species. Curr. Biol. 30: 2520-2531. e7.
- Takano S, Fukuda K, Koto A, Miyazaki R. (2019) A novel system of bacterial cell division arrest implicated in horizontal transmission of an integrative and conjugative element. PLoS Genet 15: e1008445.
環境に応答した植物-根粒菌共生の制御
窒素栄養が豊富に存在する環境下において、植物が根粒形成を抑制する際に働く転写因子LjNLP4を同定した 。(Nat Commun 2018)
また、LjNLP4とそのホモログであるLjNLP1が硝酸に応答した遺伝子発現のマスターレギュレーターとして機能することを明らかにした。
(Plant Cell 2021)
さらに、硝酸イオン輸送体LjNRT2.1がLjNLP4/1を介した根粒形成制御のハブとして機能することを明らかにした。
(Plant Cell 2022)
- Nishida H, Tanaka S, Handa Y, Ito M, Sakamoto Y, Matsunaga S, Betsuyaku S, Miura K, Soyano T, Kawaguchi M, Suzaki T (2018) A NIN-LIKE PROTEIN mediates nitrate-induced control of root nodule symbiosis in Lotus japonicus. Nat Commun 9:499.
- Nishida H, Nosaki S, Suzuki T, Ito M, Miyakawa T, Nomoto M, Tada Y, Miura K, Tanokura M, Kawaguchi M, Suzaki T (2021) Different DNA-binding specificities of NLP and NIN transcription factors underlie nitrate-induced control of root nodulation. Plant Cell 33: 2340-2359.
- Misawa F, Ito M, Nosaki S, Nishida H, Watanabe M, Suzuki T, Miura K, Kawaguchi M, Suzaki T (2022) Nitrate transport via NRT2.1 mediates NIN-LIKE PROTEIN-dependent suppression of root nodulation in Lotus japonicus. Plant Cell in press.
バイオフィルムの形成メカニズムの解明と制御法開発
Curliは大腸菌のバイオフィルムの形成に重要な細胞外機能性アミロイドである。我々は、Curliの生成には分子シャペロンDnaKの多重タスクが必要であることを明らかにした。(Commun. Biol. 2018)
また、DnaKと協調的に機能する3つのJドメインタンパク質の機能的ヒエラルキーを明らかにした。(J. Mol. Biol. 2021)
さらに、黄色ブドウ球菌が環境中のRNAをバイオフィルムの構成要素として利用する仕組みを解明した。
(npj Biofilms Microbiomes, 2022)
- Sugimoto S, Arita-Morioka KI, Terao A, Yamanaka K, Ogura T, Mizunoe Y (2018) Multitasking of Hsp70 chaperone in the biogenesis of bacterial functional amyloids. Commun Biol. 1:52.
- Sugimoto S, Yamanaka K, Niwa T, Terasawa Y, Kinjo Y, Mizunoe Y, Ogura T (2021) Hierarchical model for the role of J-domain proteins in distinct cellular functions. J Mol Biol. 433(3):166750.
- Chiba A, Seki M, Suzuki Y, Kinjo Y, Mizunoe Y, Sugimoto S. (2022) Staphylococcus aureus utilizes environmental RNA as a building material in specific polysaccharide-dependent biofilms. npj Biofilms Microbiomes. doi: 10.1038/s41522-022-00278-z
ラマン分光を用いた糸状菌およびバイオフィルムの無標識分子イメージング
微生物細胞およびその集団中の物質分布をラベルフリーで可視化できるラマンイメージングを多変量データ解析MCR-ALSや重水素標識と組み合わせて、糸状菌菌糸の様々な部位(特に菌糸先端)におけるシトクロムを含むタンパク質の分布と代謝ダイナミクスを明らかにした。(Anai Chem 2019, Sci Rep 2021)また、実環境から採取したピンクバイオフィルムを、構成微生物の細胞内ポリエン化合物のラマン信号を用いて可視化し、微生物分布の不均一性を染色を行うことなく明らかにした。(Sci Rep 2020)
- Yasuda M, Takeshita N, Shigeto S (2019) Inhomogeneous Molecular Distributions and Cytochrome Types and Redox States in Fungal Cells Revealed by Raman Hyperspectral Imaging Using Multivariate Curve Resolution-Alternating Least Squares. Anal Chem 91: 12501-12508.
- Horiue H, Sasaki M, Yoshikawa Y, Toyofuku M, Shigeto S (2020) Raman spectroscopic signatures of carotenoids and polyenes enable label-free visualization of microbial distributions within pink biofilms. Sci Rep 10: 7704.
- Yasuda M, Takeshita N, Shigeto S (2021) Deuterium-labeled Raman tracking of glucose accumulation and protein metabolic dynamics in Aspergillus nidulans hyphal tips. Sci Rep 11: 1279.
プラスミドが生み出す細菌集団の多様性
プラスミドは供与菌から受容菌へ接合伝達により移動する。我々は、複数の受容菌存在下で供与菌が特定の受容菌を選り好むことを見出した。
(mSphere, 2018)
また、プラスミド獲得後の細胞内応答において、宿主染色体由来の核様体タンパク質やsmall RNAが果たす役割を明らかにした。
(Front Microbiol, 2020)
さらに、遺伝的に均一な細菌集団中でプラスミド由来遺伝子の発現と形質が多様化することを一細胞レベルで明らかにした。(in prep)
- Sakuda A, Suzuki-Minakuchi C, Okada K, Nojiri H (2018) Conjugative selectivity of plasmids is affected by coexisting recipient candidates. mSphere 3: e00490-18
- Nakamura T, Suzuki-Minakuchi C, Kawano H, Kanesaki Y, Kawasaki S, Okada K, Nojiri H (2020) H-NS family proteins drastically change their targets in response to the horizontal transfer of the catabolic plasmid pCAR1. Front Microbiol 11: 1099
- Kawano H, Suzuki-Minakuchi C, Sugiyama D, Watanabe N, Takahashi Y, Okada K, Nojiri H (2020) A novel small RNA on the Pseudomonas putida KT2440 chromosome is involved in the fitness cost imposed by IncP-1 plasmid RP4. Front Microbiol 11: 1328
芳香環族化合物の生合成機構の解明と利用
含窒素ヘテロ芳香族化合物であるピラジンの生合成遺伝子クラスターを発見し、その生合成メカニズムを明らかとした。(ChemBioChem, 2020)
バニリンに次ぐ需要がある天然香料ラズベリーケトンの微生物生産システムを構築した。(Front Bioeng Biotechnol, 2022)
紙パルプ原料から芳香族化合物を発酵生産し、これをモノマー原料として史上最高の耐熱性を示す機能性プラスチックを開発した。
(Adv Sustainable Syst, 2021)
- Masuo S, Tsuda Y, Namai T, Minakawa H, Shigemoto R, Takaya N. (2020) Enzymatic Cascade in Pseudomonas that Produces Pyrazine from α‐Amino Acids. ChemBioChem. 21(3):353-359
- Masuo S, Saga C, Usui K, Sasakura Y, Kawasaki Y, Takaya N. (2022) Glucose-Derived Raspberry Ketone Produced via Engineered Escherichia coli Metabolism. Front Bioeng Biotechnol. 10:843843
- Nag A, Ali MA, Kawaguchi H, Saito S, Kawasaki Y, Miyazaki S, Kawamoto H, Adi DTN, Yoshihara K, Masuo S, Katsuyama Y, Kondo A, Ogino C.,Takaya N, Kaneko T, Ohnishi Y. (2021) Ultrahigh Thermoresistant Lightweight Bioplastics Developed from Fermentation Products of Cellulosic Feedstock. Adv Sustainable Syst. 5(1):200193
細菌がつくる膜小胞の解析法開発
細菌が細胞外に放出する一粒子の膜小胞(MVs)が持つ物理化学的表面特性を評価する方法を高速原子間力顕微鏡を用いて開発した。
(Nanoscale, 2020)
これにより、細菌が放出する膜小胞の物性に種特異的な多様性があることを示した。また、磁性細菌がつくる細胞内膜小胞であるマグネトソームの細胞内動態の可視化技術(mBio, 2017)を確立し、細菌の膜オルガネラの形成や制御の分子機構を解析した。
- Kikuchi Y, Obana N, Toyofuku, M, Kodera N, Soma T, Ando T, Fukumori Y, Nomura N, Taoka A (2020) Diversity of physical properties of bacterial extracellular membrane vesicles revealed through atomic force microscopy phase imaging. Nanoscale 12:7950-7959.
- Taoka A, Kiyokawa A, Uesugi C, Kikuchi Y, Oestreicher Z, Morii K, Eguchi Y, Fukumori Y (2017) Tethered Magnets Are the Key to Magnetotaxis: Direct Observations of Magnetospirillum magneticum AMB-1 Show that MamK Distributes Magnetosome Organelles Equally to Daughter Cells. mBio 8:e00679-17.









