
研究総括 四方 哲也
(元 大阪大学 大学院情報科学研究科 教授)
研究期間:2009年~2014年
生命の定義としてよく引用されているのは「進化可能な自律的化学反応システム」です。しかし、すべての人がこの定義を受け入れているわけでもなく、また、細胞の持つダイナミックな反応容器(動的微小反応場)としての性質がこの定義の中に十分反映されているわけでもありません。このプロジェクトでは、細胞の持つ性質、すなわち1)微小区画での反応の高効率性、確率性、頑強性、2)成長分裂する微小区画による再帰性、3)変異と選択による進化能の3点に着目して、これらの性質をもつ動的微小反応場を既知物質から創りあげました。そして、4)その性質を単細胞生物である大腸菌などと比較しました。この創出と比較のサイクルを繰り返すことによって、生命の最小単位である細胞を新しい視点から捉えなおし、人工細胞創出の設計指針を得ることを目指しました。この目的を達成するために、細胞生物学だけでなく、生化学、物理化学、理論生物学、また微小反応場を設計するマイクロ・ナノ工学などの広範囲な専門分野から研究者を招きました。その中から新しい領域を切り開く人材を育成することを目指しました。
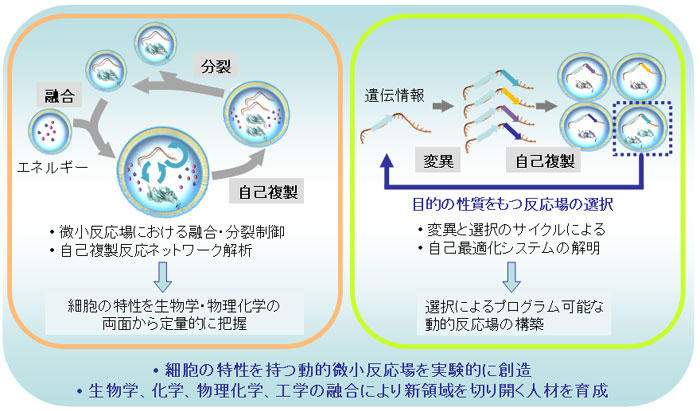
研究成果
(1)「進化の機能」を持った人工細胞の作成に成功
生物の機能を人工的に再構築した人工細胞の作成は、新たなテクノロジーとして近年大きな注目を集めています。しかし、従来の人工細胞は生物の大きな特徴である進化する能力を持っておらず、その応用範囲は限定されていました。
RNAからなる人工ゲノムと数十種類のたんぱく質などを細胞サイズの油中水滴注2)に封入した人工細胞を作成しました。この人工細胞内では、ゲノムRNAから遺伝情報が翻訳され複製酵素が合成されます。そして、合成された複製酵素により元のゲノムRNAの複製が起こります。さらに、この人工細胞を、栄養(たんぱく質合成に必要な酵素・アミノ酸など)を含んだ油中水滴と人為的に融合・分裂をさせることにより、天然の細胞と同じように際限なくゲノムの複製を続けることに成功しました。また、この人工細胞を長期に培養した結果、複製エラーによりゲノムRNAに突然変異が蓄積し、より複製しやすいゲノムRNAが自然選択により進化することを見いだしました。これはダーウィンが提唱した進化のメカニズムを持った人工細胞が誕生したことを意味しています。
生物の進化はいまだに多くの謎に包まれています。その一因は、進化の直接観察が難しいことにあります。本研究で作成した人工細胞は、その進化を試験管内で再現し直接観察することができるため進化過程の詳細な理解に役に立つと期待されます。また、この人工細胞を基盤としてさらに多くの能力を進化させていくことにより、天然の生物に頼らないより効率的な食糧や薬剤の生産に貢献できると期待されます。
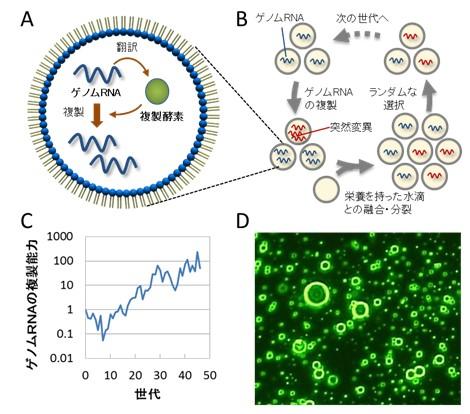
人工細胞におけるゲノムRNAの進化
油中水滴に封入されたゲノムRNAは自身にコードされた複製酵素により自己複製する(A)。この自己複製を、栄養を持った水滴との融合と分裂を繰り返すことにより、長期間継代した(B)。その結果、複製の中で複製エラーにより突然変異が導入されたことにより、変異型のゲノムRNAの中に元のRNAよりもより多くの子孫を残すものが現れ、その後の細胞の分裂とランダムな選択過程を経るにつれて元のRNAを駆逐するようになった。この過程を繰り返した結果、ゲノムRNAの複製能力は元の約100倍まで進化した(C)。融合直後の人工細胞の顕微鏡写真(D)。写真に写っている全ての輪、あるいは点は、サイズの異なる人工細胞である。
- Darwinian evolution in a translation-coupled RNA replication system within a cell-like compartment
Ichihashi, N., Usui, K., Kazuta, Y., Sunami, T., Matsuura, T., and Yomo, T.
Nat Commun 2013, 4, 2494
(2)モデル細胞膜が、高分子を内封すると自発的に分裂することを発見
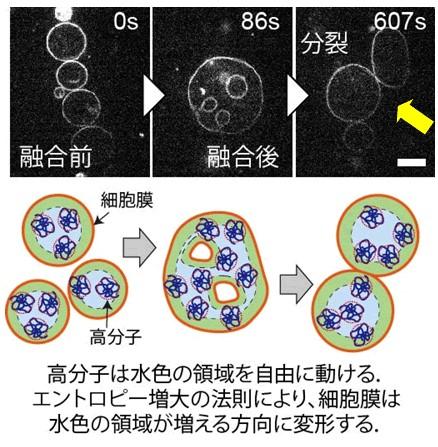
約40億年前に誕生した初期の細胞(原始細胞)は、遺伝物質が脂質膜の袋で包まれただけの単純なものであり、この原始細胞が増殖し進化することで、高度で複雑な機構を持つ現代の生命に至ったと考えられています。現在の生物を構成する細胞は、たんぱく質などの制御によって成長し分裂することで増殖しますが、このような仕組みを持たない原始細胞がどのように分裂し増殖し得たのか、その過程はいまだ謎に包まれたままです。
原始細胞を模倣した単純なモデル細胞膜(リン脂質膜)を用いた実験により、膜の袋に分子量数千~数万ダルトンの高分子を内封している場合、内部の高分子が動ける空間をできるだけ広げようとする物理的効果に従ってモデル細胞膜の分裂が起きることを発見しました。この膜分裂は、複数のモデル細胞膜が融合して膜の面積が大きくなると自発的に起こる現象であり、原始細胞のように高度な制御機構を持たないものでも、成長して分裂する(増殖する)ことができた可能性を示唆するものです。
※以下のリンクから、動画の閲覧が可能です
https://youtu.be/sY64KXAexIA
https://youtu.be/OCqvxpDAo-o
- Coupling of the fusion and budding of giant phospholipid vesicles containing macromolecules
Terasawa, H., Nishimura, K., Suzuki, H., Matsuura, T., and Yomo, T.
Proc. Natl. Acad. Sci. USA 2012, 109, 5942-5947.
(3)人工細胞を使って膜たんぱく質を「進化」させる技術の開発
変異と選択を繰り返すというダーウィン進化を実験室で再現し、生体高分子であるたんぱく質の性質を改変・改良する方法は、1990年代に開発されて以来、医薬品の開発などに世界中で大きな成果を挙げてきています。しかし、膜たんぱく質は一般に不溶性であり、かつ異種細胞での発現が困難であるという性質を持つため、生理学的・産業的に重要であるにも関わらず、人工的な改変はほとんどされていませんでした。
たんぱく質合成に必要な物質を内封した細胞サイズの人工脂質二重膜小胞(リポソーム)内で、遺伝子から膜たんぱく質を合成することにより、その人工細胞膜上に膜たんぱく質が組み込まれることを見いだしました。さらに、人工細胞の外部から内部へ物質が取り込まれるという膜たんぱく質の活性も確認できました。
次に、膜たんぱく質の遺伝子に変異を導入した集団の中から、より機能の高い膜たんぱく質をコードする遺伝子を選択してくることに成功しました。この手法を用いることにより、膜たんぱく質の1つであるα-ヘモリシンの機能を野生型よりも約30倍も人工的に「進化」させることに成功しました。この高機能α-ヘモリシンは、これまでに開発されているα-ヘモリシンを利用したDNA配列解析装置の高性能化へつながることが期待されます。
さらに、「リポソームディスプレイ法(liposome display)」と名付けたこの手法は、さまざまな膜たんぱく質に適用可能です。ある特定の物質を高い選択性で透過させる膜たんぱく質を用いた高性能バイオセンサーの創出や、膜たんぱく質に強く結合することによりその機能を阻害する新たな薬の発見など、多方面への波及効果が期待されます。
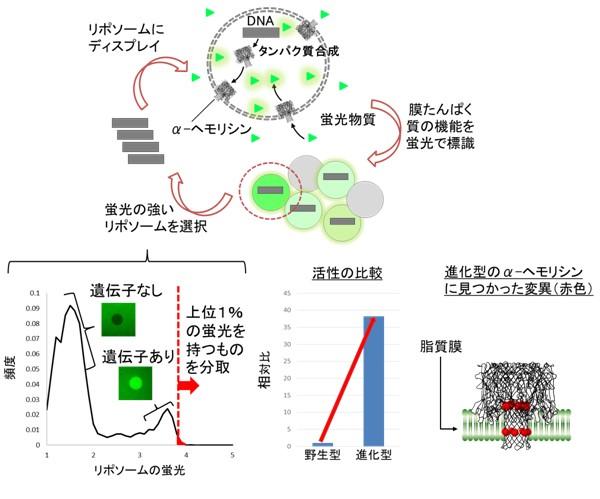
リポソームディスプレイによるα-ヘモリシンの「進化」
α-ヘモリシンの遺伝子に人工的に変異を導入します。この遺伝子をリポソーム内部に封入すると、α-ヘモリシンのたんぱく質が合成されます。合成されたたんぱく質はリポソームの脂質膜に刺さり、小さな穴を開けます。穴の数が多い程、より多くの蛍光物質が流入します。より多くの蛍光物質を流入させたリポソームを分取し、内部のDNAを取り出して同様の作業を繰り返すと、穴を形成しやすい遺伝子が得られます。左下のグラフは実際に蛍光輝度と頻度を表したヒストグラムです。遺伝子が入っていないリポソームは暗く、遺伝子が入っているリポソームは明るいことが分かります。明るいリポソームの中でも特に蛍光輝度が高いリポソームを分取します。中央下のグラフは本研究によって得られた「進化」型と野生型の膜たんぱく質活性を測定した結果です。右下の図は進化型のα-ヘモリシンを解析した結果、変異が見つかった部位を赤色で示しています。ちょうど脂質膜に組み込まれる部分に変異が集中している様子が見られます。
- In vitro evolution of alpha-hemolysin using a liposome display
Fujii, S., Matsuura, T., Sunami, T., Kazuta, Y., and Yomo, T.
Proc. Natl. Acad. Sci. USA 2013, 110, 16796-16801.