
研究総括 斎藤 通紀
(京都大学 大学院医学研究科 教授)
研究期間:2011年10月~2017年3月
特別重点期間:2017年4月~2018年3月
グラント番号:JPMJER1104
全能性とは、個体を構成するあらゆる細胞に分化し、個体を形成する能力のことを言います。個体の出発点である受精卵が全能性を獲得するメカニズムの理解はまだまだ十分ではありません。受精卵から精子や卵子の源となる始原生殖細胞へ、始原生殖細胞から精子や卵子へ、そして再び全能性を持つ受精卵へと、世代を超えて遺伝情報を継承する仕組みの中では、ゲノム機能を制御するゲノム上のさまざまな修飾-その総体をエピゲノムと呼びます-が次々に変化することが知られています。全能性獲得に至るエピゲノム制御機構の理解は、細胞の医療応用の観点からも非常に重要な課題です。
本プロジェクトでは、生殖細胞のもつエピゲノム制御機構を、マウス、さらにはよりヒトに近いカニクイザルをモデル生物として、解明・再構成し、全能性獲得に至るゲノム制御基盤を明らかにすることを目指します。この過程において微量サンプルからエピゲノムを定量・解析する技術を開発します。これらの研究から得られる知見は、ヒト生殖細胞研究の基盤となり、不妊、先天性の疾患・症候群、ある種の遺伝病などの原因解明、細胞のエピゲノムを制御する新しい技術の開発につながることが期待されます。
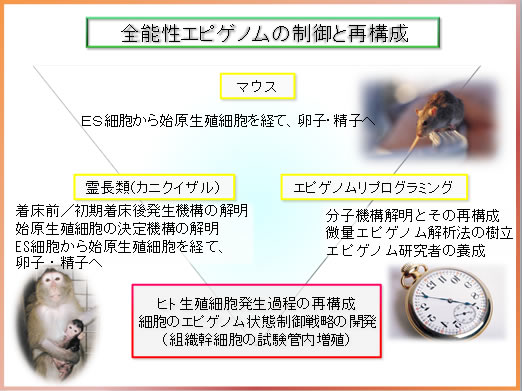
研究成果の概要
生殖細胞は、精子・卵子に分化し、その融合により新しい個体を形成、遺伝情報やエピゲノム情報を次世代に継承する。生殖細胞の発生機構の解明は、遺伝情報継承・エピゲノム制御機構、不妊や遺伝病発症機序の解明につながる。
本プロジェクトでは、マウスES細胞/iPS細胞から、精子・卵子・健常な産仔に貢献する始原生殖細胞様細胞の試験管内誘導に成功した。本系を用いて、始原生殖細胞を誘導する転写・シグナル機構の解明、エピゲノムリプログラミング機構の解明、始原生殖細胞増殖法の開発、始原生殖細胞から精子幹細胞の試験管内誘導、卵母細胞分化・減数分裂誘導機構の解明、性染色体異常不妊マウスからの産仔の産出、などに成功した。また、ヒトiPS細胞からヒト始原生殖細胞様細胞の誘導に成功し、ヒトに固有の転写制御機構を解明した。さらに、カニクイザルを用いた研究を推進し、マウス・サル・ヒトにおける多能性スペクトラムの発生座標の解明、霊長類生殖細胞の起源が初期羊膜であることを見出した。ヒト生殖細胞発生過程のさらなる再構成研究を推進中である。
研究成果
マウス生殖細胞解析グループ
マウスにおける生殖細胞発生機構の理解を深め、生殖細胞発生過程の培養系による再現を進展させる。本グループは、マウス多能性幹細胞から始原生殖細胞様細胞を経て卵子を誘導し産仔を得ること (Science, 2012)、転写因子による始原生殖細胞様細胞の誘導と精子・産仔の産出 (Nature, 2013)、始原生殖細胞様細胞から試験管内で精原幹細胞を誘導し精子・産仔の産出 (Cell Reports, 2016)、始原生殖細胞様細胞の増殖法の開発とエピゲノムリプログラミングの誘導 (EMBO J, 2017)、雌性生殖細胞分化機構の解明 (EMBO J, 2017)、を含む成果をあげた。今後は、雌性生殖細胞分化を誘導する転写機構、減数分裂における相同染色体組み替え機構、雄性生殖細胞分化を誘導するシグナル・転写機構の解明を目指す。
代表論文
- Hayashi, K., et al. Offspring from oocytes derived from in vitro primordial germ cell-like cells in mice. Science, 338, 971-975, 2012.
- Nakaki, F., et al. Induction of mouse germ-cell fate by transcription factors in vitro. Nature, 501, 222-226, 2013.
- Ishikura, Y., et al. In Vitro Derivation and Propagation of Spermatogonial Stem Cell Activity from Mouse Pluripotent Stem Cells, Cell Reports, 17, 2789-2804, 2016.
- Ohta, H., et al. In vitro expansion of mouse primordial germ cell-like cells recapitulates an epigenetic blank slate, The EMBO Journal, 36, 1888-1907, 2017.
- Miyauchi, H., et al. Bone morphogenetic protein and retinoic acid synergistically specify female germ cell fate in mice, The EMBO Journal, 36, 3100-3119, 2017.
サル生殖工学開発グループ
ヒトの着床前・後胚発生及び生殖細胞形成の遺伝学的・後成遺伝学的機構は解明されておらず、また実験に供するには倫理的側面による限界がある。そこで、ヒトにより近い霊長類を用いて、その生殖細胞発生機構の解明と試験管内再構成を行う必要がある。本グループではこうした研究に必要となるカニクイザル卵と胚を安定して供給するための生殖工学基盤技術を確立する。研究期間を通して上述の目標を達成し、またトランスジェニックカニクイザル作製技術の開発に成功した (Sci. Rep., 2016)。本グループは、今後は、カニクイザル胚の安定した供給とともに、ノックアウトカニクイザルの安定した作成を目指す。
代表論文
- Seita, Y., et al. Generation of transgenic cynomolgus monkeys that express green fluorescent protein throughout the whole body, Scientific Reports, 6:24868 (DOI: 10.1038/srep24868), 2016.
サル初期発生機構解析グループ
カニクイザルの着床前・後胚発生及び生殖細胞形成機構を解明し、カニクイザルにおける生殖細胞発生過程の培養系による再現を目指す。本グループは、単一細胞mRNA 3-prime RNA sequence法(SC3-seq)の開発 (NAR, 2015)、マウス・サル・ヒトにおける多能性スペクトラムの発生座標の解明 (Nature, 2016)、霊長類生殖細胞が初期羊膜を起源とすること(Dev. Cell, 2016)、を含む成果をあげた。今後は、カニクイザル発生過程におけるX染色体の動態解明、カニクイザル生殖細胞発生機構の試験管内再構成を目指す。
代表論文
- Nakamura, T., et al. SC3-seq: A method for highly parallel and quantitative measurement of single-cell gene expression, Nucleic Acids Research, 43, e60, 2015.
- Nakamura, T., et al. A developmental coordinate of pluripotency among mice, monkeys, and humans, Nature, 537, 57-62, 2016.
- Sasaki, K., et al. The Germ Cell Fate of Cynomolgus Monkeys is Specified in the Nascent Amnion, Developmental Cell, 39, 169-185, 2016.
生殖エピゲノム解析グループ
エピゲノムリプログラミングの実体とその分子機構を解明することを目的とする。本グループは、PGCsにおけるゲノムワイドなDNA脱メチル化が受動的な機構による可能性の提唱 (EMBO J, 2013)、PRDM14のmESCsの機能維持・エピゲノム制御における役割の解明 (Cell Stem Cell, 2013)、マウス始原生殖細胞様細胞誘導過程におけるクロマチン修飾動態 (Cell Stem Cell, 2015) 及びDNAメチル化動態 (Dev. Cell, 2015)の解明、BLIMP1の多彩な細胞系譜における作動機序の提唱 (NAR, 2017)、を含む成果をあげた。今後は、生殖サイクルを通したエピゲノム制御の全体像解明を目指す。
代表論文
- Kagiwada, S., et al. Replication-coupled passive DNA demethylation for the erasure of genome imprints in mice. The EMBO Journal, 32, 340-353, 2013.
- Yamaji, M., et al. PRDM14 ensures naïve pluripotency through dual regulation of signaling and epigenetic pathways in mouse embryonic stem cells. Cell Stem Cell, 12, 368-382, 2013.
- Kurimoto, K., et al. Quantitative Dynamics of Chromatin Remodeling during Germ Cell Specification from Mouse Embryonic Stem Cells, Cell Stem Cell, 16, 517-532, 2015.
- Shirane, K., et al. Global Landscape and Regulatory Principles of DNA Methylation Reprogramming for Germ Cell Specification by Mouse Pluripotent Stem Cells, Developmental Cell, 39, 87-103, 2016.
- Mitani, T., et al. Principles for the regulation of multiple developmental pathways by a versatile transcriptional factor, BLIMP1, Nucleic Acids Research, (doi: 10.1093/nar/gkx798), 2017.
ヒト始原生殖細胞発生機構再構成グループ
hESCs/iPSCsを用いたヒト生殖細胞発生機構の試験管内再構成とその評価を行う。本グループは、ヒトiPSCsからヒト始原生殖細胞様細胞の誘導 (Cell Stem Cell, 2015)、ヒトiPSCクローンによる生殖細胞誘導効率の差異とその要因の可能性 (BOR, 2017)、ヒト始原生殖細胞様細胞形成に固有なシグナル・転写機構の解明 (Cell Stem Cell, 2017)、を含む成果をあげた。今後は、ヒト始原生殖細胞様細胞から卵母細胞や精原細胞を誘導する系の確立とその評価を目指す。
代表論文
- Sasaki, K., et al. Robust In Vitro Induction of Human Germ Cell Fate from Pluripotent Stem Cells, Cell Stem Cell, 17, 178-194, 2015.
- Yokobayashi, S., et al. Clonal Variation of Human Induced Pluripotent Stem Cells for Induction into the Germ Cell Fate, Biology of Reproduction, 96, 1154-1166, 2017.
- Kojima, Y., Sasaki, K., Yokobayashi, S., Sakai, Y., Nakamura, T., Yabuta, Y., Nakaki, F., Nagaoka, S., Woltjen, K., Hotta, A., Yamamoto, T., and Saitou, M. Evolutionarily Distinctive Transcriptional and Signaling Programs Drive Human Germ Cell Lineage Specification from Pluripotent Stem Cells, Cell Stem Cell, 21, 517-532, 2017.
これら以外に、マウス生殖細胞解析グループの国際共同研究として、性染色体異常(トリソミー)に起因する不妊マウスからiPS細胞・始原生殖細胞様細胞を誘導し、産仔を得ることに成功した (Science, 2017)。
- Hirota, T., et al. (2017). Fertile offspring from sterile sex chromosome trisomic mice, Science, 357, 932-935.