 研究総括 末松 誠
研究総括 末松 誠
(慶應義塾大学 医学部 教授)
研究期間:2009年~2014年
 相手側研究総括
相手側研究総括
Gregg L. Semenza(グレッグ セメンザ)
(ジョンズ・ホプキンス大学 細胞工学研究所)
ガス分子(O2、NO、CO、H2S、CO2など)は、地球の太古における単細胞生物が外界の環境変化を感知する信号として利用してきたことが知られていますが、現代の哺乳類においても蛋白質、脂質や糖質などと同様に生体の構成成分として生物作用の発揮に重要な役割を果たしています。本研究領域では、バイオシミュレーションを活用した代謝システム予測や、細胞内におけるガス分子濃度解析などのマクロ的視点の研究と、細胞内におけるガス分子と代謝を促す分子(酵素)との結合における分子構造の変化の解析など、代謝システム内における化学反応の解明といったミクロ的視点の研究を相補的に行い、ガス分子が介在する代謝機構の解明を目指します。さらに、代謝機構の解析により得られた知見を活用しつつ、酵素や代謝変動の局在の細胞レベルでの精密な解析、体内特定部位での代謝作用におけるガス分子の役割のより詳細な解明を進め、特定の臓器のガス分子環境の人為的な制御・調節の実現といったガス分子の特性を利用した病態制御技術の基礎を確立し、がん研究や薬物代謝・毒性メカニズムといった応用研究への端緒を得ることを目指します。
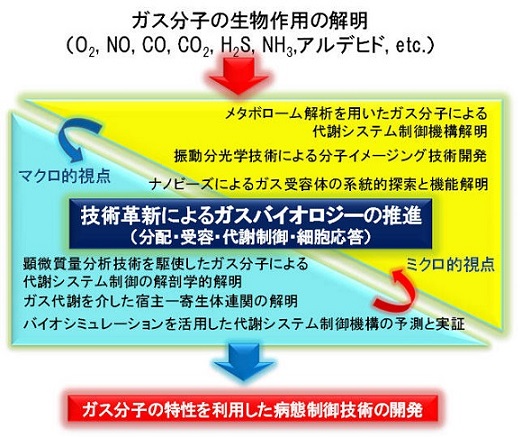
研究成果の概要
ガス分子は生体内で生成される極小分子群であり、これらの生物作用は多数報告があるものの直接ガスが反応する受容体については知見が少ない。その技術的困難を克服するために本プロジェクトでは(1)ガス分子が配位結合できる金属中心を有するたんぱく質(多くの場合、酵素)の機能変化を酵素の機能変化による代謝物変動として検出するメタボロミクスを活用し探索、(2)ガス分子が配位しうる金属中心を有する補欠分子を抱合したアフィニティナノビーズによって「ガス応答性たんぱく質候補」を先に釣り上げ、その中から生物学的意義が明らかにされていない分子に的を絞って解析、という2つの手法を編み出した。CO受容体として前者によりCystathionine beta-synthase (CBS), 後者によりPGRMC1がCO応答たんぱく質として同定され、それぞれ低酸素性血管拡張反応の制御やがん細胞の生存機序の解明に繋がった。また一連の成果によって、質量分析イメージング技術によりこれまで困難であった殆どの低分子代謝物のイメージングが可能になる一方、chemical biologyを用いてこれらの受容体を戦略的に同定することが可能になった。
研究成果
(1)ケミカルバイオロジーコアグループ(加部グループリーダ):
本研究グループは、CO、NO、O2などのガス分子に対する未知の応答性因子について、独自のアフィニティ精製技術を駆使して系統的探索を行い、これによって得られた因子群に関して、分子生物学的、分光学的、情報生物学的、構造生物学的な解析を行うことにより、ガス応答制御反応を分子レベルで解明し、ガス分子を介した未知の生理機能の解明を行うことを目的としている。この成果として、新たなCO応答性タンパク質PGRMC1を同定した(図左上)。PGRMC1は、progesteroneが結合する1回膜貫通型の細胞膜タンパク質として同定され各種はがん細胞に高発現している事が知られているが、その機能については不明であった。我々は、PGRMC1のX線結晶構造解析により、PGRMC1が113番目のチロシン残基を介した特異な様式でヘム配位することを見出し(図左下)、タンパク表面上に突出したヘム同士が会合した特異なheme-stacking oligomer構造を取ることを世界で初めて解明した(図右上)。生化学的な解析から、PGRMC1はヘムの無いapo構造ではmonomer構造を示すが、ヘムと結合することにより重合化し、さらにCOガスはtyrosine-Fe-COの6配位構造を取ることでheme-stacking構造が解離して機能変換されることを見出した(図右下)。さらに、PGRMC1の構造的制御とがん細胞における機能解析を行い、PGRMC1はヘムにより2量体化することによって、がん増殖に関わる上皮成長因子の受容体(EGFR)と会合してこれによるがん増殖シグナルを増強することを新たに見出した。また2量体化したPGRMC1は薬物代謝酵素であるシトクロムP450 とも会合して抗がん剤の分解活性を増強して、がん細胞の薬剤耐性を亢進することを明らかとした。このような活性化機構に対して、COはheme-stacking構造を解離してこれらの相互作用を阻害し癌抑制に働くことを明らかにした。これらの新規の構造的制御に基づいたPGRMC1のがん増殖および薬剤耐性獲得の機能を指標として、PGMRC1に結合してその機能を阻害する化合物が見つかれば新たな抗がん剤の開発に繋がる可能性があり、新たな創薬開発のための非常に重要な情報となるものと考えられる。(本研究の成果をJST、慶應義塾及びAMEDで「新規ヘムタンパク質の構造と機能の解明-がんの増殖と薬剤耐性に関与-」としてプレスリリース)
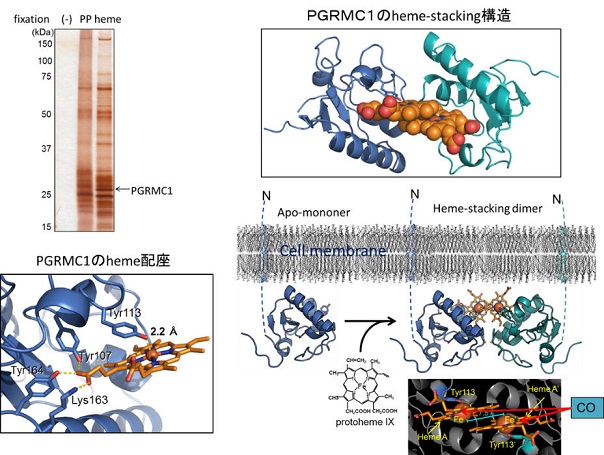
図 新規ガス応答性タンパク質PGRMC1の同定とその構造的機能制御の解明
ヒト由来がん細胞株の異種移植モデルを用い、これまで困難とされてきたアミノ酸の質量分析イメージングの技術を確立、がん細胞やヒト由来のiPS細胞から樹立した心筋細胞の増殖・生存に関わるアミノ酸・乳酸代謝の解析法の確立を通じて、がんの化学療法耐性機構解明や心筋細胞の純化培養法などの確立を推進するなどの貢献をした。
- Haem-dependent dimerization of PGRMC1/Sigma-2 receptor facilitates cancer proliferation and chemoresistance. Kabe Y, Nakane T, Koike I, Yamamoto T, Sugiura Y, Harada E, Sugase K, Shimamura T, Ohmura M, Muraoka K, Yamamoto A, Uchida T, Iwata S, Yamaguchi Y, Krayukhina E, Noda M, Handa H, Ishimori K, Uchiyama S, Kobayashi T, Suematsu M. Nat Commun. 2016 Mar 18;7:11030. doi: 10.1038/ncomms11030
- Glutamine oxidation is indispensablefor survival of human pluripotent stem cells. Tohyama S, Fujita J, Hishiki T, Matsuura T, Hattori F, Ohno R, Kanazawa H, Seki T, Nakajima K, Kishino Y, Okada M, Kuroda T, Seki T, Nakajima K, Kishino Y, Okada M, Hirano A, Kuroda T, Yasuda S, Sato Y, Yuasa S, Sano M, Suematsu M, Fukuda K. Cell Metabolism, 2016 accepted for publication
- CO-CBS-H2 S axis: From vascular mediator to cancer regulator. Suematsu M, Nakamura T, Tokumoto Y, Yamamoto T, Kajimura M, Kabe Y. Microcirculation. 2015 Nov 5. doi: 10.1111/micc.12253
- Impacts of CD44 knockdown in cancer cells on tumor and host metabolic systems revealed by quantitative imaging mass spectrometry. Ohmura M, Hishiki T, Yamamoto T, Nakanishi T, Kubo A, Tsuchihashi K, Tamada M, Toue S, Kabe Y, Saya H, Suematsu M. Nitric Oxide. 2015 Apr 30;46:102-13. doi: 10.1016/j.niox.2014.11.005.
- Microscopic imaging mass spectrometry assisted by on-tissue chemical derivatization for visualizing multiple amino acids in human colon cancer xenografts. Toue S, Sugiura Y, Kubo A, Ohmura M, Karakawa S, Mizukoshi T, Yoneda J, Miyano H, Noguchi Y, Kobayashi T, Kabe Y, Suematsu M. Proteomics. 2014 Apr;14(7-8):810-9. doi: 10.1002/pmic.201300041.
(2)バイオイメージングコアグループ(梶村グループリーダ):
ガス分子の標的候補分子に酵素が多いことから、必要な新技術開発の基軸として「空間情報を破壊せず、顕微鏡の空間分解能で代謝物/代謝システム動態を包括的かつ定量的に評価できる質量イメージング技術の開発(Imaging MS)」「代謝物のfootprintを正確に読み取り、ガス分子の消長により反応する代謝システムを同定する技術の開発」の2つを目標においた。質量分析情報を空間的に二次元で取得し画像化する質量分析(MS)イメージング技術が開発され、形態情報を保ったまま細胞内メディエータや代謝分子等の微量成分を測定し、さらにタンデム質量分析(MSn)を行うことによりフェムトモルの感度で未知の代謝産物の構造を決定することが可能となった。この画期的な技術と、これまでプロジェクトで培ってきたメタボローム解析のノウハウを駆使し、ガス分子が「いつ、どこで、どのように」働くかを的確に捉えるための基盤技術として定量的質量分析イメージング法の開発に至った。さらにこれまで測定が困難であった生体内の微量の硫化水素や過硫化物を、超高速トリプル四重極型LC-MS/MSシステム(LCMS-8030)を用い、Multiple Reaction Monitoringモードにより選択的かつ高感度に定量することに成功した。
- Therapeutic hypothermia achieves neuroprotection via a decrease in acetylcholine with a concurrent increase in carnitine in the neonatal hypoxia-ischemia. Takenouchi T, Sugiura Y, Morikawa T, Nakanishi T, Nagahata Y, Sugioka T, Honda K, Kubo A, Hishiki T, Matsuura T, Hoshino T, Takahashi T, Suematsu M, Kajimura M, J. Cerebr. Blood Flow Metab. 2015, 35, 794-805. doi: 10.1038/jcbfm.2014.253.
- Large-area surface-enhanced Raman spectroscopy imaging of brain ischemia by gold nanoparticles grown on random nanoarrays of transparent boehmite. Yamazoe S, Naya M, Shiota M, Morikawa T, Kubo A, Tani T, Hishiki T, Horiuchi T, Suematsu M, Kajimura M. ACS Nano, 2014, 8, 5622-5632. (C&EN にて報道)
- Hypoxic regulation of the cerebral microcirculation is mediated by a carbon monoxide-sensitive hydrogen sulfide pathway. Morikawa T, Kajimura M, Nakamura T, Hishiki T, Nakanishi T, Yukutake Y, Nagahata Y, Ishikawa M, Hattori K, Takenouchi T, Takahashi T, Ishii I, Matsubara K, Kabe Y, Uchiyama S, Nagata E, Gadalla MM, Snyder SH, Suematsu M. Proc. Natl. Acad. Sci. U. S. A., 2012, 109, 1293-1298.(朝日新聞、日刊工業新聞、科学新聞)
- Paradoxical ATP elevation in ischemic penumbra revealed by quantitative imaging mass spectrometry. Hattori K, Kajimura M, Hishiki T, Nakanishi T, Kubo A, Nagahata Y, Ohmura M, Yachie-Kinoshita A, Matsuura T, Morikawa T, Nakamura T, Setou M, Suematsu M. Antioxid. Redox Signal. (News and Views), 2010, 13, 1157-1167. (表紙採用)
(3)メディカルアプリケーションコアグループ(南嶋グループリーダ):
CO-H2S系など、ガス状分子のクロストーク機構を解明する動物モデルの構築は、硫化水素(H2S)合成酵素の一つCBSの生体内での役割に着目して研究を進め、CBSがビタミンD受容体の特異的転写共役因子としてカルシウム代謝を制御している可能性を示し、論文投稿準備中である。がん細胞におけるCOの意義は、抗がん剤などのストレスを受けたがん細胞では、産生量が増加したCOによってCBSの活性が抑制され、メチル化レベルが低下した糖代謝酵素PFKFB3の酵素活性が低下し、グルコースの代謝経路が解糖系からペントースリン酸経路へと切り替わり、がん細胞が酸化ストレスなどから自身を防御するための物質を産生していることを論文で発表した(「抗がん剤が効かなくなるがん細胞の新たなメカニズムの発見」としてJSTおよび慶應義塾大学でプレスリリース)。ガス応答性タンパク質の遺伝子改変動物の作製と表現型解析は、ミトコンドリアにおいて硫化水素(H2S)の分解系を阻害したマウスを用いて、H2Sの分解機構の破綻がミトコンドリアの傷害を引き起こすことを示し、そのメカニズムについて論文投稿中である。低酸素応答による細胞内エネルギー代謝制御機構の解明は、酸素濃度センサー分子PHD2の活性を阻害することによって、肝臓での血中乳酸クリアランス能力が強化され、敗血症などに合併する乳酸アシドーシスの生存率を劇的に改善することを論文で発表した。今後、PHD阻害剤(腎性貧血治療薬として治験中)を用いた乳酸アシドーシスの新規治療法の開発へと発展させる予定である。質量イメージング法による組織切片中のガス分子の局在の可視化法の開発は、アンモニアなど、今まで組織切片で検出が困難であったガス分子のガス関連分子との複合体としての検出法を開発し、検出出来たイオンに関して新規にデータベース化した。継続してH2Sのイメージング法の開発を行っている。低酸素におけるCBSの発現誘導機序、及び役割の解明は、低酸素環境において、ラット脳におけるCBSの発現誘導がHIF依存的に起こることを詳細に明らかとした。また、CBSノックダウンの解析から、CBSがHIF-2αの発現を負に制御していることを明らかとした。(JH大共同研究)
- Energy management by enhanced glycolysis in G1-phase in human colon cancer cells in vitro and in vivo. Bao Y, Mukai K, Hishiki T, Kubo A, Ohmura M, Sugiura Y, Matsuura T, Nagahata Y, Hayakawa N, Yamamoto T, Fukuda R, Saya H, Suematsu M, Minamishima YA. Mol Cancer Res. 2013 Sep;11(9):973-85.
- Reduced methylation of PFKFB3 in cancer cells shunts glucose towards the pentose phosphate pathway. Yamamoto T, Takano N, Ishiwata K, Ohmura M, Nagahata Y, Matsuura T, Kamata A, Sakamoto K, Nakanishi T, Kubo A, Hishiki T, Suematsu M. Nat Commun. 2014 Mar 17;5:3480. (JSTおよび慶應義塾大学でプレスリリース)
- Hypoxia-inducible factors regulate human and rat cystathionine s-synthase gene expression. Takano N, Peng YJ, Kumar GK, Luo W, Hu H, Shimoda LA, Suematsu M, Prabhakar NR, Semenza GL. Biochem J. 2014 Mar 1;458(2):203-11.
- Decreased expression of cystathionine β-synthase promotes glioma tumorigenesis. Takano N, Sarfraz Y, Gilkes DM, Chaturvedi P, Xiang L, Suematsu M, Zagzag D, Semenza GL. Mol Cancer Res. 2014 July 3, 10; 1398-406
- Inhibition of the oxygen sensor PHD2 in the liver improves survival in lactic acidosis by activating the Cori cycle. Suhara T, Hishiki T, Kasahara M, Hayakawa N, Oyaizu T, Nakanishi T, Kubo A, Morisaki H, Kaelin WG Jr, Suematsu M, Minamishima YA. Proc Natl Acad Sci U S A. 2015 Sep 15;112(37):11642-7. (JSTおよび慶應義塾大学でプレスリリース)