
研究総括 金井 求
(東京大学 大学院薬学系研究科 教授)
研究期間:2011年10月~2017年3月
特別重点期間:2017年4月~2018年3月
グラント番号:JPMJER1103
細胞は統合された化学反応の場であり、生命活動は触媒の一種である酵素の活性によって支えられています。極めて単純化した表現を用いると、病態とは酵素活性が適正値より低下あるいは亢進しすぎた状態であると言えます。これまでの多くの医薬は、酵素活性を調節することで薬理作用を発揮してきました。近年の生物科学の進歩により創薬ターゲットの分子機構が解明されてきている一方、薬理作用が期待できる分子でも複雑な構造を持つために合成コストが高くなり、医薬品の開発候補から除外されてしまうことがあります。また、バイオ医薬や再生医療など新しい医薬や治療の概念が提唱されはじめています。本プロジェクトでは、”触媒”をキーワードに、
(1) 複雑な構造を持つ医薬候補物質を短工程、かつ地球環境を汚染せずに合成できる革新的触媒の開発
(2) 触媒自体が医薬となるという新しい概念”触媒医療”を志向した、生体内の酵素機能と置き換えられる人工触媒システムの開発
の方向性を掲げ、物質科学と生命科学の融合の下で相乗的に研究を行いました。
研究成果
【触媒グループ】
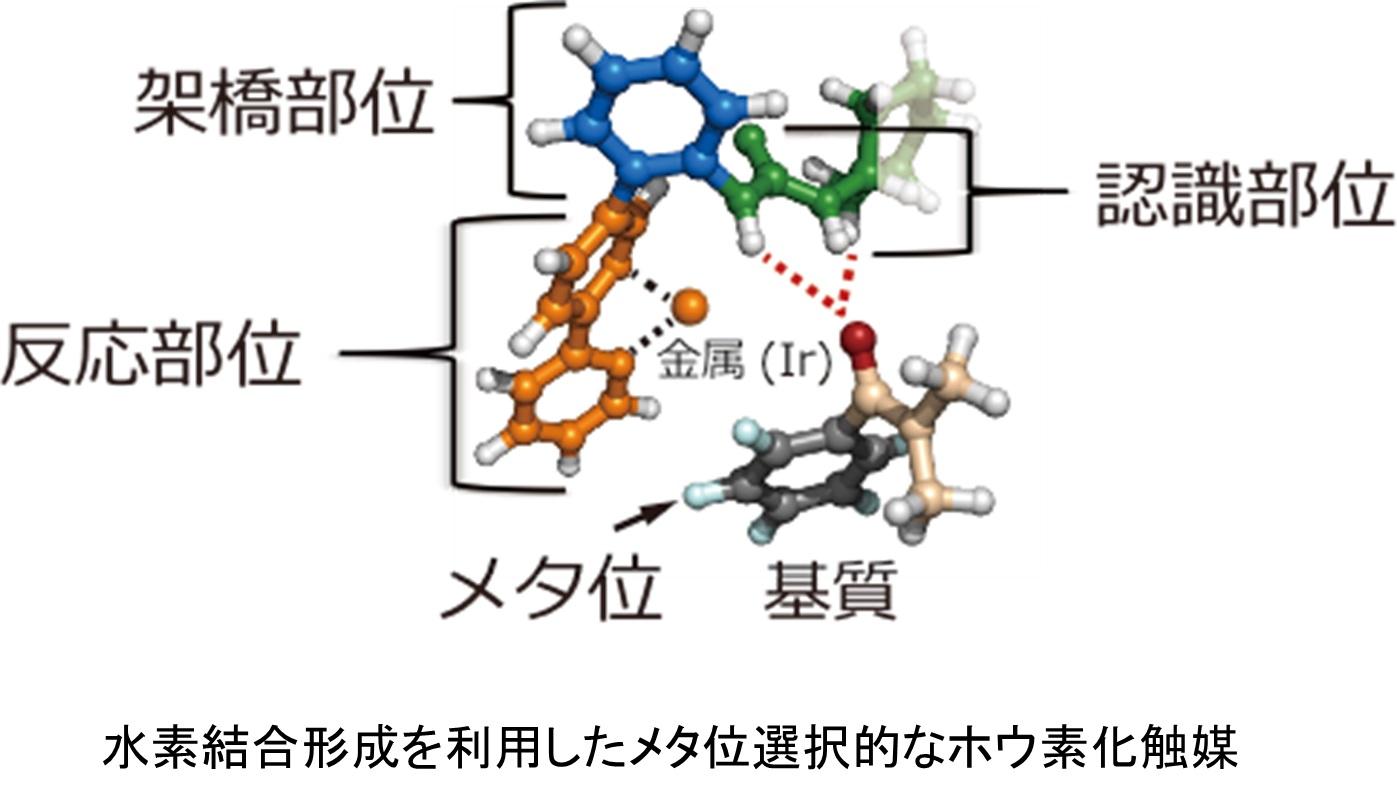
触媒グループでは、複雑な構造を有する医薬リードを短工程で迅速に、かつ地球環境を汚染することなく合成できる、革新的な炭素-水素(C-H)結合変換触媒反応の開発を行いました。代表的な成果として、医薬の部分構造として重要な複素環に対する位置選択的フルオロアルキル基の導入反応や水素結合形成を利用したメタ位選択的なホウ素化反応などを開発しました。また、C-O, C-N結合等の各種結合形成反応の開発も行いました。これらの反応は合成終盤での多官能基性基質に対しても適用できることから、高効率な官能基導入法として複雑な医薬品や生物活性分子合成のための強力な手法になりうるものと期待されます。
- "Lewis Acid-Base Interaction-Controlled ortho-Selective C-H Borylation of Aryl Sulfides" Li, H. L.; Kuninobu, Y.; Kanai, M. Angew. Chem. Int. Ed. 2017, 56, 1495.
- "4-Position-Selective C-H Perfluoroalkylation and Perfluoroarylation of Six-Membered Heteroaromatic Compounds" Nagase, M; Kuninobu, Y.; Kanai, M. J. Am. Chem. Soc. 2016, 138, 6103.
- "Benzylic C(sp3)-H Perfluoroalkylation of Six-Membered Heteroaromatic Compounds" Kuninobu, Y.; Nagase, M.; Kanai, M. Angew. Chem. Int. Ed. 2015, 54, 10263.
- "A meta-selective C-H borylation directed by a secondary interaction between ligand and substrate" Kuninobu, Y.; Ida, H.; Nishi. M.; Kanai, M. Nat. Chem. 2015, 7, 712.
- "Palladium-Catalyzed Oxirane-Opening Reaction with Arenes via C-H Bond Activation" Wang, Z.; Kuninobu, Y.; Kanai, M. J. Am. Chem. Soc. 2015, 137, 6140.
- "Regioselective Trifluoromethylation of N-Heteroaromatic Compounds Using Trifluoromethyldifluoroborane Activator" Nishida, T.; Ida, H.; Kuninobu, Y.; Kanai, M. Nat. Commun. 2014, 5, 3387.
【医薬機能グループ】
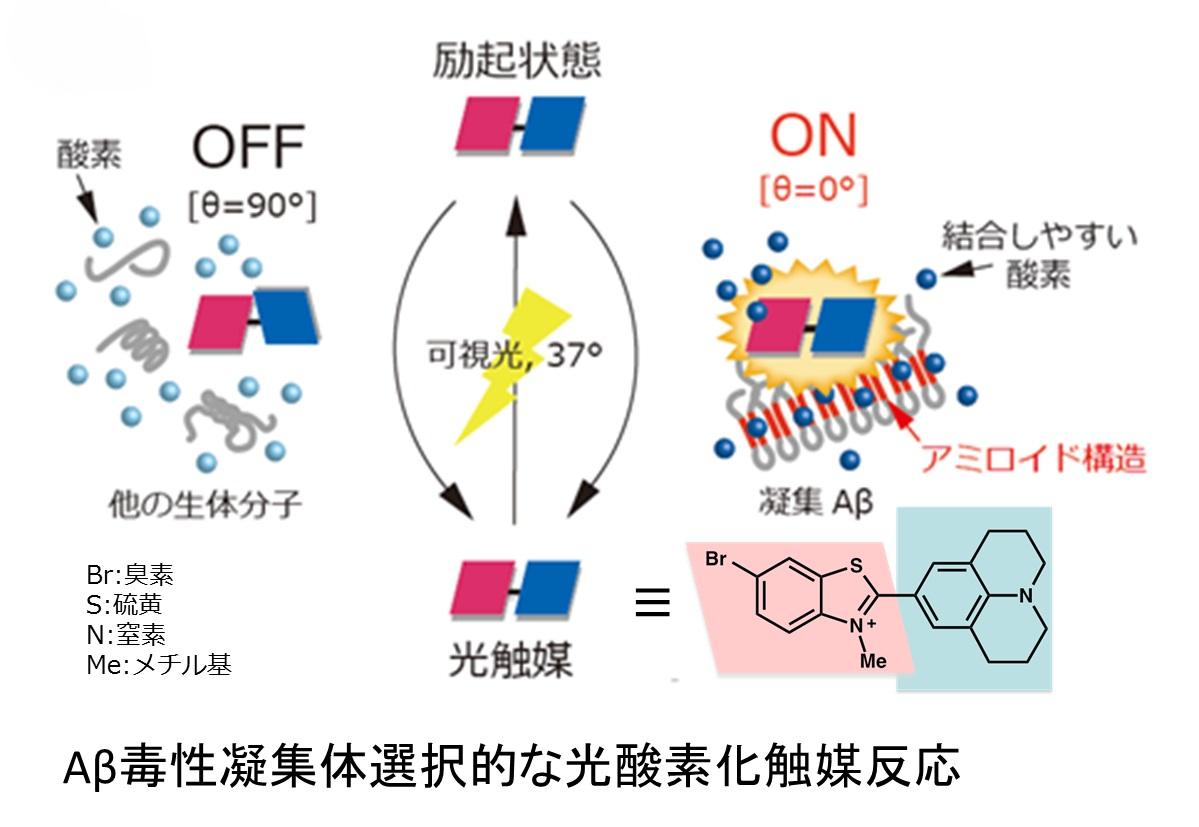
アルツハイマー病の発症には、アミロイドβペプチド(Aβ)が脳神経細胞外にて凝集線維化し、神経細胞を傷つけることが関与していると考えられています。医薬機能グループでは、この病原性Aβ凝集体を標的としたアルツハイマー病の革新的治療法の開発を目指して、(1) 病原性Aβの凝集阻害剤の開発と、(2) 病原性Aβを標的とする人工触媒の開発を行いました。凝集阻害剤の開発ではAβの毒性凝集体の形成を阻害する独自の低分子医薬骨格を見出しました。また人工触媒の開発では、生細胞存在下、Aβ毒性凝集体を選択的に酸素化することにより、凝集性を低減させ無毒化する光触媒を開発しました。本触媒は、タンパク質の質制御をおこなうタンパク質分解系の人工触媒ミミックとみなすことができ、標的を化学変換反応により無毒化することで本疾患の根本的治療への貢献が期待されます。
- "Near-Infrared Photoactivatable Oxygenation Catalysts of Amyloid Peptide" Ni, J.; Taniguchi, A.; Ozawa, S.; Hori, Y.; Kuninobu, Y.; Saito, T.; Saido, T. C.; Tomita, T.; Sohma, Y.; Kanai, M. Chem 2018, DOI: 10.1016/j.chempr.2018.02.008.
- "Switchable Photooxygenation Catalysts that Sense Higher-Order Amyloid Structures" Taniguchi, A.; Shimizu, Y. Oisaki, K.; Sohma, Y.; Kanai, M. Nat. Chem. 2016, 8, 974.
- "A Cyclic KLVFF-Derived Peptide Aggregation Inhibitor Induces the Formation of Less-Toxic Off-Pathway Amyloid-β Oligomers" Arai, T.; Sasaki, D.; Araya, T.; Sato, T.; Sohma, Y.; Kanai, M. ChemBioChem 2014, 15, 2577.
- "Asparagine-Selective Cleavage of Peptide Bonds through Hypervalent Iodine-Mediated Hofmann Rearrangement in Neutral Aqueous Solution" Tanabe, K.; Taniguchi, A.; Matsumoto, T.; Oisaki, K.; Sohma, Y.; Kanai, M. Chem. Sci. 2014, 5, 2747.
- "Attenuation of the Aggregation and Neurotoxicity of Amyloid-β Peptides by Catalytic Photooxygenation" Taniguchi, A.; Sasaki, D.; Shiohara, A.; Iwatsubo, T.; Tomita, T.; Sohma, Y. Kanai, M. Angew. Chem. Int. Ed. 2014, 53, 1382.
- 金井求、相馬洋平、谷口敦彦、佐々木大輔、「触媒的酸化によるアミロイドβペプチドの凝集お呼び毒性発現の抑制」特開2015-17082.
- 金井求、相馬洋平、Ni Jizhi、谷口敦彦、「クルクミンホウ素錯体及びこれを含有する医薬」特願2016-056615.
【触媒医療グループ】
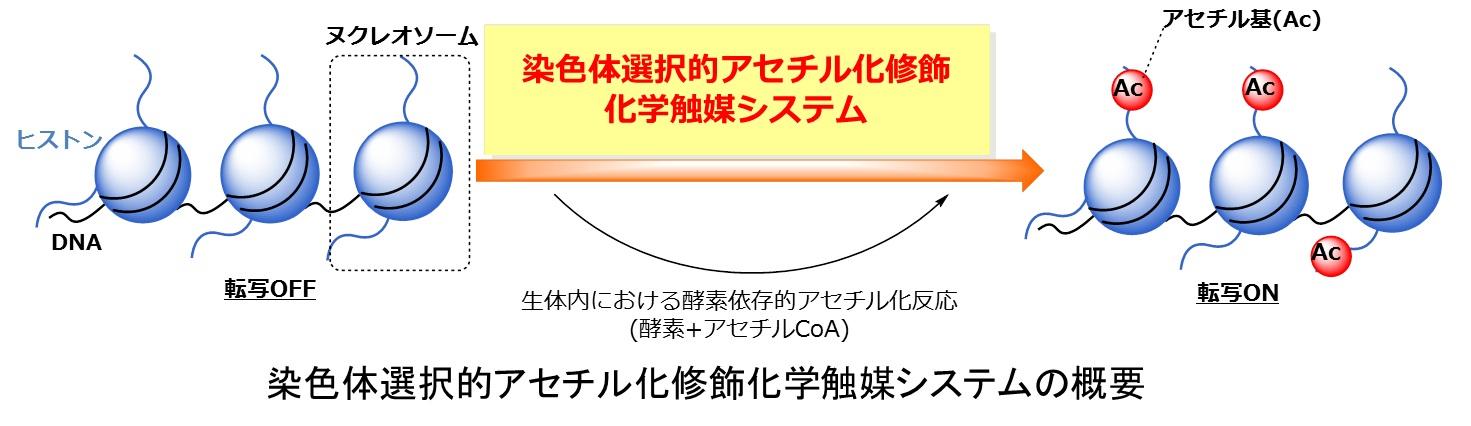
生命現象は、生体分子が酵素”触媒”により構造変化する動的化学反応ネットワークシステムから発現し、その異常が病態を引き起こすと考えられます。生体内化学反応を媒介するのが生物”触媒”である酵素ならば、化学”触媒”を生細胞環境に導入して、人工的な化学秩序の創発による新しい病態治療”触媒医療”が可能なのではないかと考えました。例えば、酵素による染色体タンパク質(ヒストン)のアセチル化修飾は遺伝子の転写を促進しますが、一部のがん細胞などでは酵素の機能が低下し、がん抑制遺伝子などの転写が抑制されていることが知られています。触媒医療グループでは、人工触媒による酵素を介さないヒストンのアセチル化修飾と、生物学的機能の発現を目指した研究を行いました。化学的知見に基づいて種々の触媒設計を行い、DNAに結合してヒストンテイル領域を広範囲にアセチル化する触媒と、ヒストン結合部位を搭載した種々のアシルCoAを活性化する位置選択的な触媒を開発しました。また、これらの人工触媒反応により、染色体を構成するクロマチンを、遺伝子転写が起こりやすい性質へ変えることができました。今後、さらなる応用により、”触媒医療”として疾患を治療する技術への発展が期待されます。
- "LC-MS/MS-based quantitative study of the acyl group- and site-selectivity of human sirtuins to acylated nucleosomes" Tanabe, K.; Liu, J.; Kato, D.; Kurumizaka, H.; Yamatsugu, K.; Kanai, M.; Kawashima, S. A. Sci. Rep. 2018, 8, 2656.
- "Synthetic Posttranslational Modifications: Chemical Catalyst-Driven Regioselective Histone Acylation of Native Chromatin" Amamoto, Y.; Aoi, Y.; Nagashima, N.; Suto, H.; Yoshidome, D.; Arimura, Y.; Osakabe, A.; Kato, D.; Kurumizaka, H.; Kawashima, S. A.; Yamatsugu, K.; Kanai, M. J. Am. Chem. Soc. 2017, 139, 7568.
- "Synthetic Chromatin Acylation by an Artificial Catalyst System" Ishiguro, T.; Amamoto, Y.; Tanabe, K.; Liu, J.; Kajino, H.; Fujimura, A.; Aoi, Y.; Osakabe, A.; Horikoshi, N.; Kurumizaka, H.; Yamatsugu, K.; Kawashima, S. A.; Kanai, M. Chem, 2017, 2, 840.
- "Supramolecular Ligands for Histone Tails by Employing a Multivalent Display of Trisulfonated Calix[4]arenes" Kimura, Y.; Saito, N.; Hanada, K.; Liu, J.; Okabe, T.; Kawashima, S. A.; Yamatsugu, K.; Kanai, M. ChemBioChem 2015, 16, 2599.
- "Intracellular activation of acetyl-CoA by an artificial reaction promoter and its fluorescent detection" Komatsu, H.; Shindo, Y.; Kawashima, S. A.; Yamatsugu, K.; Oka, K.; Kanai, M. Chem. Commun. 2013, 49, 2876.
- 金井求、川島茂裕、山次健三、天本義史、青井勇樹、永島臨、胡桃坂仁志、越坂部晃永、有村泰宏、「選択的な染色体タンパク質のアシル化を行うための人工触媒システム」特願2015-169448, PCT/JP2016/075183.
- 金井求、川島茂裕、山次健三、朱海燕、天本義史、田辺佳奈、石黒伸茂、劉家安、「生体内のアシル化機能と置き換えられる人工触媒システム」PCT/JP2015/066179.