
総括責任者 楠見 明弘
(名古屋大学 大学院理学研究科 教授)
研究期間:1998年10月~2003年9月
細胞が、多細胞生物の中で他の細胞と相互作用して機能するためには、細胞膜が可塑的で多機能なシステムとして働くことが必須であるが、その構築原理と作働機構の多くは未解明のままでした。本プロジェクトでは、1分子ナノテクノロジー技術を用いて、細胞膜の組織化の機構と人工の素子や機械にはない可塑性による細胞膜の多機能化の機構の解明を目指しました。その結果、細胞膜の機能発現を制御する細胞膜コンパートメント化の仕組み/働きを解明し、細胞膜上でのシグナル変換システムの基本的なアルゴリズムの理解を深めることができました。これらの成果は、細胞と多細胞社会の構造形成機構の新しい概念を樹立し、さらに、可塑的な多機能素子の設計に指針を与えるものと考えられます。特に、細胞膜上の情報変換システムの理解が進み、バイオメディカル分野、生命科学分野に根本的な影響を与えると期待されます。
成果
新たな細胞膜組織化機構(アンカード膜タンパク質の「ピケット効果」)の発見
膜骨格の網目構造は、膜タンパク質に対して「フェンス」のように働く。そのフェンスに加えて、膜骨格に沿って立ち並んだ膜貫通型タンパク質が、立体障害と流体力学的な摩擦効果によって、膜分子の拡散に対する障壁として働いていることを見出した。膜骨格のフェンスとそのピケットが、膜分子の動的組織化に重要な役割を果している。
1分子光ピンセット顕微鏡による細胞膜ピケットフェンスの直接的可視化
膜骨格の網目構造は、膜タンパク質に対して「フェンス」のように働く。そのフェンスに加えて、膜骨格に沿って立ち並んだ膜貫通型タンパク質が、立体障害と流体力学的な摩擦効果によって、膜分子の拡散に対する障壁として働いていることを見出した。膜骨格のフェンスとそのピケットが、膜分子の動的組織化に重要な役割を果している。
神経細胞膜の極性維持のための「膜の仕切り」の解明
1分子観察・操作法を用いて、神経細胞の発達に伴い膜貫通型タンパク質分子の「ピケット」が密集して細胞膜上の「仕切り」となり、神経細胞膜で入出力領域間での分子の混合を防いで分子の分布を正しく保つことを解明した。
生細胞内でのGFPの1蛍光分子ビデオイメージングを世界で初めて実現
細胞間接着分子E-カドヘリンとGFPとの融合タンパク質1分子の生細胞形質膜上での可視化に成功し、細胞接着領域以外の自由表面でもE-カドヘリンが会合体を形成することを見いだした。
生細胞でのRas分子活性化の1分子イメージング
生細胞において、1分子FRET(蛍光共鳴エネルギー移動)によって、H-Ras1分子の位置や運動だけでなく、その分子の活性化の瞬間を1分子レベルで観察することに成功した。それに基づき、短寿命シグナル分子複合体によりRasのシグナル伝達は時空間的に厳密に制御されていることを見出した。
細胞膜ドメイン/ラフトの構造と機能の解明
ラフト様ドメインのマーカー分子の1分子観察により、定常状態でラフトは小さく(数分子程度)不安定(ミリ秒以下の寿命)であり、信号入力によって、ラフトは安定化し、ここに、さまざまな下流分子をリクルートする事を明らかにした。ラフトは可塑的な構造で、信号パスの調整や、クロストークに基本的な役割を果す、ことが示唆された。
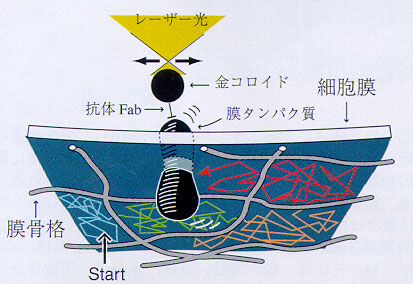
▲一分子レベルで、受容体の運動や集合を観察・操作する。受容体は、膜骨格による制限を受けながらホップ拡散運動していることがわかってきた。
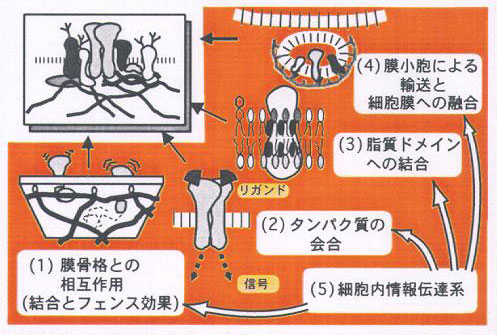
▲細胞膜分子の組織化(会合-局在化-集合/配列構造形成)に重要な5つの素過程(私達のグループの提案)