
研究総括 河岡 義裕
(東京大学 医科学研究所 教授)
研究期間:2008年~2013年
これまでの精力的な研究にも関わらず、インフルエンザウイルスの病原性発現機構や宿主との相互作用、そしてウイルス感染による宿主細胞応答のネットワークについてはほとんどわかっておらず、このことが感染予防ならびに治療方法の開発の遅れにつながっていると考えられました。
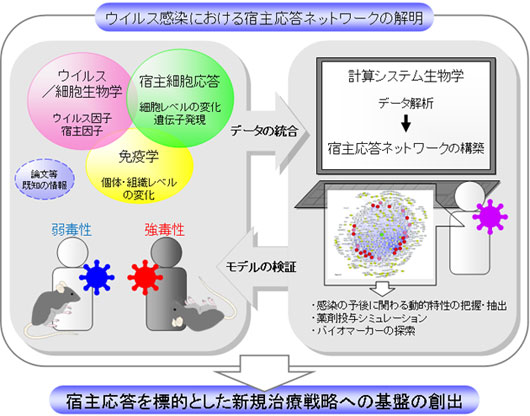
本プロジェクトでは、宿主応答の全体像を宿主応答ネットワークとして体系化し、新たな感染予防法および治療法の開発に向けて、インフルエンザウイルスと感染細胞および個体との攻防を理解することを目的としました。具体的には、培養細胞と実験動物をもちいたウイルス感染実験から(I)ウイルス感染過程、(II)ウイルス蛋白質-宿主因子の相互作用、(III)ウイルス感染時の宿主応答プロファイル、の情報を統合し、情報統計学的手法で解析することで、ウイルス感染にともなう一連の変化を宿主応答ネットワークとして体系化することを目的としました。また拡大研究として、2009年のパンデミックウイルスや新たにヒトの間で問題となっているウイルスの性状解析を行い、病原性発現機構の解明やパンデミックポテンシャルに関する研究を行いました。
その結果、1)インフルエンザウイルス増殖に関与する宿主因子の同定、2)感染部位においてウイルス量がある一定値を越えた場合にのみ、過剰な免疫反応が起こり、組織障害が悪化し重症化に至るという閾値モデルの提唱、3)遺伝子再集合のメカニズム解明に繋がるインフルエンザウイルス粒子中のウイルス遺伝子の立体構造解析、4)高病原性H5鳥インフルエンザウイルスの飛沫伝播に関わるアミノ酸変異の同定、5)2009年新型インフルエンザウイルスの性状解析、6)2013年に中国でヒトから分離されたH7N9鳥インフルエンザウイルスの性状解析といった成果を上げることができました。
研究成果集
1. インフルエンザウイルス増殖に関与する宿主因子
インフルエンザウイルス感染に関わる宿主因子についての文献を網羅的に検索および精査した。また、既存のパスウェイデータベース上の情報や文献から、それらの宿主因子の細胞内における機能を調べ、インフルエンザウイルス感染に関わる細胞内パスウェイモデルを構築した。検索は、ウイルス増殖に直接関わる宿主因子だけでなく、感染によって引き起こされる宿主応答に関わる因子についても拡張して解析した。論文530本以上から、960 のSpecies (分子、複合体等の因子), 456 のReactions(状態遷移反応)を盛り込み、476本の論文の注釈をつけたモデルが構築できている。また、構築されたパスウェイマップに対し、ネットワーク解析の手法の1つである Controllability解析(可制御性解析)を適用し、ネットワークの構造からみて制御に重要な役割を果たすと思われる要素を特定した(Matsuoka et al., BMC Syst Biol, 2013)。このような文献ベースの網羅的パスウェイモデルは、インフルエンザウイルスの増殖環の全体像をとらえ、ウイルスと宿主との相互作用について分子レベルで理解する上で非常に有用であると考える。
また、インフルエンザウイルス蛋白質と相互作用する宿主因子を免疫沈降法と質量分析法を用いて同定した。これらの因子すべてに対し、RNA干渉(RNAi)法を用いてそれらの発現を抑制させ、ウイルス増殖への影響を調べた。さらに、ウイルス増殖を抑制した因子について、それらがウイルス増殖のどのステップに関与するか詳細な解析を行った。その結果、この一連の実験で、細胞膜上にあるF1Fo-ATPaseの構成因子のひとつであるF1が、インフルエンザウイルス粒子形成に重要であることを見出した(Gorai et al., PNAS, 2012)。
2. マウスにおけるインフルエンザウイルス感染に対する宿主応答
病原性の異なるインフルエンザウイルスを感染させたマウスにおける宿主応答を検証した。肺全体の遺伝子発現データから肺における個々の免疫細胞の動態を推測できるツール「CTen」を開発し、これを用いて感染マウスの肺の遺伝子データを解析したところ、インフルエンザウイルスに感染したマウスの肺では、免疫細胞ではマクロファージが活性化していることが明らかとなった(Shoemaker et al., BMC Genomics, 2013)。さらに、ウイルス感染初期に発現が変化する遺伝子群のネットワーク解析をしたところ、その多くはインターフェロン誘導遺伝子であること、またそのネットワークの中心がIRF7であることが明らかとなった。さらなる解析の結果、我々は、”IRF7によって制御される宿主応答ネットワークは、ある一定のウイルス量(閾値)まではほとんど反応が起こらないが、一度閾値を超えると激しい宿主反応が起こる”という抗ウイルス応答閾値モデルを提唱した。すなわち、増殖したウイルスの量が閾値を超えた場合にのみ、過剰な抗ウイルス応答や急性炎症反応が誘導され、感染部位における組織障害が悪化し、重症化に至ると考えられる。この閾値モデルは、インフルエンザウイルス感染後の宿主の運命を説明できる1つの新しい理論であると考える。
3. インフルエンザウイルスの遺伝子再集合の機構を理解するための基礎研究
インフルエンザウイルスは8本の遺伝子を持っており、同じ細胞に2種類以上の異なるインフルエンザウイルスが同時に感染すると、ウイルス同士の遺伝子の一部が入れ替わる場合がある(遺伝子再集合)。近年では、2009年に発生した新型インフルエンザウイルスによるパンデミックは、ヒト、ブタ、鳥由来のインフルエンザウイルスの遺伝子再集合によって発生した。遺伝子再集合のメカニズムを解明するためには、インフルエンザウイルスの8本の遺伝子が、どのようにウイルス粒子中に取り込まれているのかを理解する必要がある。走査型透過電子顕微鏡を用いた電子線トモグラフィー法により、インフルエンザウイルス粒子内に取り込まれたウイルス遺伝子(リボヌクレオ蛋白質複合体)の立体構造を明らかにした。得られた立体構造から、8種類のウイルス遺伝子分節が核酸様のヒモ状構造物を介して互いに結合し、1つの超複合体を形成することが明らかになった(Noda et al., Nat Communi, 2012)。本成果は、インフルエンザウイルスが自身の遺伝子を子孫ウイルスに伝えるメカニズムの一端を明らかにしたものであり、さらにウイルス増殖における遺伝子超複合体の重要性を示している。また、遺伝子超複合体の形成には遺伝子分節同士の適合性も大きく関与することが予測される。そのような遺伝子分節間の適合性は、遺伝子再集合の機構を解明するため必要な基礎知識としても重要である。
4. 高病原性H5鳥インフルエンザウイルスの飛沫伝播に関わるアミノ酸変異の同定
インフルエンザウイルスの感染や伝播には、ウイルス粒子表面にあるHA蛋白質が大きく関与しており、ヒト型のレセプターを認識するHA蛋白質を持つウイルスは、ヒトで効率よく感染し、伝播する可能性が高くなる(Imai and Kawaoka, Curr Opin Virol, 2012)。本研究では、H5N1ウイルスのヒトへの適応に関わる変異を同定するために、まず、H5亜型のHAにランダムに変異を有するウイルス集団を作製し、その中からヒト型のレセプターを認識する変異HAを持つウイルスを選抜した。
次に、インフルエンザ感染のモデル動物であるフェレットを用いて、この変異H5亜型ウイルスの感染・伝播実験を行ったところ、コントロールの野生型H5HAを持つウイルスはフェレット間で飛沫伝播をしなかったのに対して、HAに合計4個の変異を持つウイルスは効率良くフェレット間で飛沫伝播をした(Imai et al., Nature, 2012)。これらの変異はHAのヒト型レセプターへの認識だけではなく、HAの安定性も重要であることが明らかとなった。本研究は、H5N1ウイルスはパンデミックを起こす可能性があり、H5N1備蓄ワクチンは必須であることを示した。さらに、抗原性の異なるH5N1ウイルスが野外で流行していることを考慮すると、よりパンデミックを起こしそうな野外ウイルスを基に備蓄ワクチンを作製することが重要であるという、ワクチン株選定の上でも大事な情報を提供した。また、今回飛沫伝播に関与することが分かった変異のうち一つはすでに多くの野外株が保有しており、さらに、もう一つ空気伝播に関与する変異を有しているウイルスがわずかながら分離されている。従って、今回得られた結果は、野外で流行しているH5N1ウイルスのパンデミックポテンシャルを評価するリスクアセスメントの観点からも非常に有用である。
5. 2009年新型インフルエンザウイルスの性状解析
2009年に発生した新型ウイルスの性状を明らかにするために、種々の動物モデルを用いてウイルスの増殖性および病原性を調べた。その結果、新型インフルエンザウイルスは、季節性インフルエンザウイルスと異なり、モデル動物の肺で効率よく増殖し、肺に重度の病変を生じさせることが分かった。この結果は、季節性インフルエンザウイルスに比べて、新型インフルエンザウイルスの病原性が強いことを示唆した(Itoh et al., Nature, 2009)。さらに、カニクイザルモデルを用いて、新型インフルエンザウイルスの中にも、病原性の比較的強い株と弱い株が存在することと、その病原性にはHAが関わっている可能性が高いことを示した(Watanabe et al.,J Virol, 2011; Watanabe et al., J Virol, 2012; Uraki et al., J Virol, 2012)。
6. 中国でヒトから分離されたH7N9鳥インフルエンザウイルスの性状解析
中国でヒトから分離されたH7N9ウイルスの性状解析をおこなった。コントロールとして、2009年に発生した豚由来のパンデミックウイルス(pdm09ウイルス)を用いた。
哺乳類モデルにおけるウイルスの病原性を調べた。2009年のpdm09ウイルスは、ヒトの季節性インフルエンザウイルスに比べて、哺乳類の呼吸器で効率良く増殖し、病原性も高い。今回、同様の動物モデルを用いて実験したところ、pdm09ウイルスと同様にH7N9ヒトウイルスは、モデル動物において季節性ウイルスよりも高い増殖性および病原性を示すことが分かった。また、H7N9ウイルスが、飛沫伝播する可能性について検討するために、フェレットモデルを用いた感染・伝播実験を行った。その結果、H7N9ヒトウイルスは、フェレットの体内で増殖するときにいくつかのアミノ酸置換を生じ、フェレット間で限定的な飛沫伝播を起こすようになった。H7N9ウイルスは、さらなる変異を獲得することによって、ヒトーヒト間で飛沫伝播する可能性があると考えられる。
さらに、人類がH7N9ウイルスに対する抗体を有するかどうか確認するため、日本で採取した人の血清について血清学的調査を行った。その結果、検査した500人全ての人がH7N9ウイルスに対する中和抗体を持っていないことが分かった。さらに、既存または未認可の抗インフルエンザ薬に対する感受性を調べたところ、マウスを用いた実験において、H7N9ウイルスは、ノイラミニダーゼ阻害剤に対する感受性が比較的低いことが明らかとなった。それに対して、承認申請の中の抗ウイルス薬、ファビピラビルは本ウイルスの増殖を強く抑制した。
以上の研究から、中国でヒトから分離されたH7N9ウイルスが、哺乳類で良く増殖できる能力を持つこと、フェレット間で限定的ながらも飛沫伝播すること、人類はH7N9ウイルスに対する免疫を持たないこと、さらに、ノイラミニダーゼ阻害剤に対する感受性が低いことが明らかとなった(Watanabe et al., Nature, 2013)。これらの結果は、H7N9ウイルスが万が一、遺伝子交雑やウイルス遺伝子の変異によって、ヒトーヒト間で効率よく空気伝播する能力を獲得すれば、パンデミックが起こり、深刻な事態を引き起こす可能性を示唆している。従って、今後もH7N9ウイルスの動向については十分に警戒する必要があり、H7N9ウイルスの徹底したサーベイランスやさらなる研究が重要であると考えられる。
研究成果
評価・追跡調査
※本プロジェクトは、ERATO研究期間終了後継続して、平成26年11月まで研究加速強化システムによりJSTが支援を行いました。