
研究総括 秋吉 一成
(京都大学 大学院工学研究科 教授)
研究期間:2011年10月~2017年3月
特別重点期間:2017年4月~2018年3月
グラント番号:JPMJER1101
生命システムは、自身の体内の状況を診断し、反応、調整、成長、再生するなどの高度な能力を有しています。近年ではこれら生命現象の巧妙な仕組みが分子レベルで明らかになってきました。またこの生体システムに啓発され、類似の機能システムを人工的に設計し応用する研究分野(バイオインスパイアードサイエンス)も発展してきています。これは病気の早期診断・計測、ドラッグデリバリーシステム(DDS)治療、再生医療などの先進医療を推進する上で重要となっている次世代バイオマテリアル開発にブレイクスルーをもたらす新たな概念です。例えば、生体内で免疫活性情報伝達を行う物質を、体外から導入し適切な場所で機能させることができれば、安全なバイオ医薬品として臨床上有効となることが期待されています。
本プロジェクトでは生体分子システムを規範として、種々のバイオ医薬品や分子マーカーの徐放制御や選択的輸送を行える機能性ナノ微粒子(バイオナノトランスポーター)を①ナノゲルテクトニクス工学、②プロテオリポソーム工学、③エキソソーム工学の3つの観点から創製することで、バイオ診断・計測やがん免疫治療、細胞工学や骨再生医療などの医療応用を目指します。
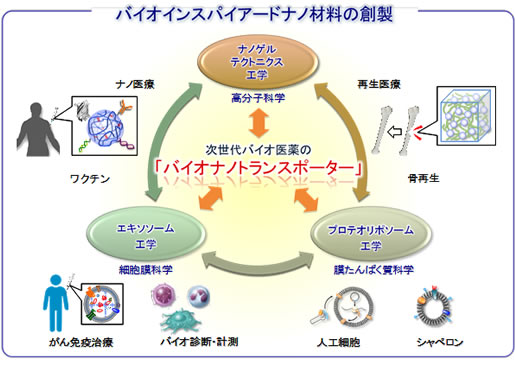
研究成果の概要
近年、核酸、タンパク質、細胞外ベシクル(エクソソーム)などのバイオ医薬品は、革新的な次世代医薬品として期待されている。その際、バイオ医薬品を安定に目的の部位に、必要な時間に送達、徐放させることのできるドラッグデリバリーシステム(DDS)や再生医療用マテリアル開発の進展が強く望まれている。我々は、生体分子システムの機能発現の仕組みを基盤とするバイオインスパイアードナノ微粒子(バイオナノトランスポーター)の創製と医療応用を展開した。具体的には、分子シャペロン機能を有する自己組織化ナノゲルを集積制御するナノゲルテクトニクス工学を提唱し、がんワクチン療法の開発と再生医療用の種々の新規ナノゲル基盤材料を開発した。また、リポソームシャペロン法による新規機能性プロテオリポソーム構築法を確立し、バイオ計測やDDS応用の基盤技術を開発した。さらに、ハイブリッドエクソソーム構築法の開発とエクソソームの病原タンパク質の血中輸送機能、T細胞由来エクソソームの新機能の解明とがん免疫治療への応用を推進した。
研究成果
(1)ナノゲルテクトニクス工学
高分子ゲルは、バイオテクノロジーや薬学・医療分野において機能性材料として幅広く利用されている。しかし、一方でその機能制御に不可欠な架橋点の構造制御やゲルの網目のナノ構造制御は依然として大きな課題である。本研究では、新規会合性高分子によるナノゲルテクトン(構築分子)の設計と、またそれらをボトムアップ法により機能性ゲルや機能性界面に組み立てるナノゲルテクトニクス(ナノゲルを基本ユニットとした高機能ゲル材料構築学)を推進し、階層的ゲルマテリアルの創製とがん免疫療法や再生療法などへの医療応用を推進した。
親水性多糖に疎水基を部分的に導入した疎水化多糖(会合性高分子)の自己会合により物理架橋ナノゲルが調製されること(自己組織化ナノゲル法)を世界に先駆けて見出し、この分野を先導してきた。自己組織化多糖ナノゲルが、タンパク質を可逆的に複合化することにより、その凝集の抑制と安定化を制御しえる、いわゆる分子シャペロン機能を発現することを見いだした。この機能は、タンパク質に対するDDS開発にブレイクスルーをもたらす重要な概念であることを本プロジェクトで実証した。例えば、多糖ナノゲルは、がん免疫ワクチン治療(現在フェーズI, IIの治験中)(三重大珠玖教授グループ)や経鼻ワクチン(肺炎球菌ワクチン等)(東大清野教授との共同)などの医療応用が進展している。
自己組織化ナノゲル(ナノゲルテクトン)をビルディングブロックとし、ボトムアップ法により階層的に構造制御された、新規ゲル材料構築法を確立した(図1)。これはナノゲルでは十分達成できない薬物の長期徐放や再生医療用の機能性足場材料の開発に新しい指針を提供するものである。通常の高分子架橋ゲルでは、ゲル中の3次元ネットワークは高分子鎖によって形成され、架橋点は高分子鎖間の共有結合によって形成される。一方で、ナノゲル架橋ゲルでは、マクロなゲル中の3次元ネットワークおよび架橋点が、ナノゲルによって形成されているという特徴をもつユニークなゲルである。特に、反応性基としてアクリロイル基を導入したナノゲルは、末端にチオール基のついたポリエチレングリコールや重合性末端を有するポリエチレングリコールと反応させることでナノゲルが生分解性の架橋で連結されたナノゲル架橋ゲルを形成し、物理架橋と化学架橋という二種類の架橋点を有する新規なゲル材料を構築しえた。これを用い、反応条件に応じてナノ微粒子、マイクロスフェア、マクロゲル、ポーラスゲル、フィルム、ファイバー、リポソームハイブリッドなどの様々な形状を有するナノゲルテクトニック材料を設計しえることを明らかにし、DDSや再生医療用足場材料としての有用性を示した。
また新規ナノキャリアとして、オリゴ糖を基盤とした両親媒性ブロックポリマーからなる、分子量依存的な物質透過性を有するグライコカプセルを開発した。
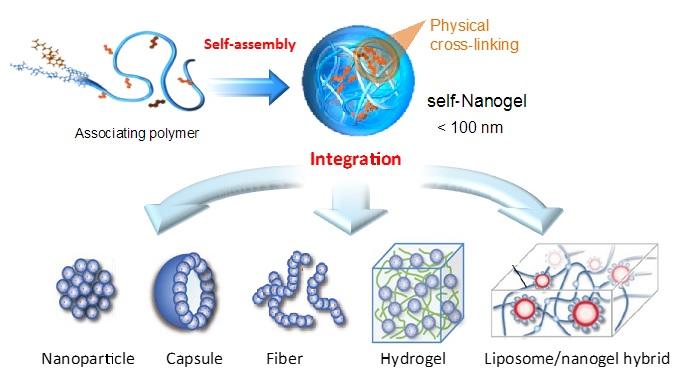
図1ナノゲルテクトニクスの概念図
代表論文
- D. Muraoka, N. Harada, T. Hayashi, Y. Tahara, F. Momose, S. Sawada, S. Mukai, K. Akiyoshi, H. Shiku, A Nanogel-based Immunologically Stealth Vaccine Targets Macrophages in the Medulla of Lymph Node and Induces Potent Anti-Tumor Immunity, ACSnano, 8, 9209-9218 (2014)
- Y. Hashimoto, S. Mukai, S. Sawada, Y. Sasaki, K. Akiyoshi, Nanogel tectonic porous gel loading biologics, nanocarriers and cells for advanced scaffold, Biomaterials, 37, 107-115 (2015)
- Y. Tahara, S. Mukai, S. Sawada, Y. Sasaki, K. Akiyoshi, Nanocarrier-integrated microspheres: Nanogel tectonic engineering for advanced drug delivery systems, Advanced Materials, 27, 5080-5088 (2015)
- Y. Hashimoto, S. Mukai, S. Sawada, Y. Sasaki, K. Akiyoshi, Advanced Artificial Extracellular Matrices Using Amphiphilic Nanogel-Cross-Linked Thin Films To Anchor Adhesion Proteins and Cytokines, ACS Biomaterials-Science & Engineering, 3, 375-384 (2016)
- T. Nishimura, Y. Sasaki, K. Akiyoshi, Biotransporting Self‐Assembled Nanofactories Using Polymer Vesicles with Molecular Permeability for Enzyme Prodrug Cancer Therapy, Advanced Materials, 29, 1702406 (2017)
(2)プロテオリポソーム工学
膜タンパク質は、バイオナノマシンとして多様な機能を有しており、近年のナノバイオテクノロジーにおいて注目されているのみならず、バイオ計測での素子としての応用も期待されている。一方で、機能を有する形態で単離精製することが難しいという大きな課題もある。本プロジェクトでは、機能性膜タンパク質を一段階でリポソームに組込む人工細胞法(リポソームシャペロン法)を開発し、効率的な無細胞膜タンパク質合成への道を切り開いた。大腸菌膜タンパク質の無細胞合成系での網羅的解析により、リポソームシャペロン法は9割以上の膜タンパク質に適用可能な汎用性が高い手法であることを明らかにした。また、種々のイオンチャネルの組込みと機能解析を行い、プロテオリポソームをバイオ計測として利用するための基盤技術を確立した。さらに、人工細胞法を利用したテーラーメイドDDSの開発を目的に、人工膜型抗体を設計し、新規イムノリポソーム構築法を確立した。
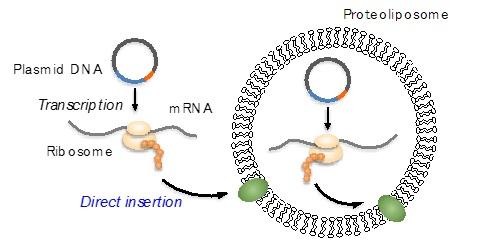
図2人工細胞法によるプロテオリポソームの構築
代表論文
- T. Niwa, Y. Sasaki, E. Uemura, S. Nakamura, M. Akiyama, M. Ando, S. Sawada, S. Mukai, T. Ueda, H. Taguchi, K. Akiyoshi, Comprehensive study of liposome-assisted synthesis of membrane proteins using a reconstituted cell-free translation system, Scientific Reports, 5, 18025 (2015)
- M. Ando, M. Akiyama, D. Okuno, M. Hirano, T. Ide, S. Sawada, Y. Sasaki, K. Akiyoshi, Liposome chaperon in cell-free membrane protein synthesis: One-step preparation of KcsA-integrated liposomes and electrophysiological analysis by the planar bilayer method, Biomaterials Science, 4, 258-264 (2016)
(3)エクソソーム工学
エクソソームは、細胞が分泌するエンドソーム由来の50-150nmのサイズを有するベシクルであり、メッセンジャーRNA (mRNA)、マイクロRNA(miRNA)や多くのタンパク質が取り込まれていることが近年明らかになった。さらに、他の細胞にRNAを運ぶシャトルとして機能することが見いだされ、新規な細胞間情報伝達機構として注目されている。本研究では、生物由来ナノ粒子キャリアとしてのエクソソーム機能に着目し、生物学的および工学的な機能改変手法の確立と新規ドラッグデリバリーシステムとしてがん免疫治療や再生医療への応用展開を行った。
エクソソームの機能化に関しては、我々が独自に展開してきたナノゲル工学あるいはリポソーム工学と融合した新規ハイブリッドエクソソーム構築法を確立した。具体的には、エクソソームに外部から脂質、タンパク質、核酸を導入しえる手法として、種々のリポソームとの融合法を開発した。また、疎水化多糖ナノゲルがエクソソーム表面を被覆することを見出し、ナノゲルの特性を利用したエクソソームの機能改変が可能となった。一方、エクソソームのシャトル機能として、核酸と比べてあまり明らかにされていなかったタンパク質の輸送と疾患の関連に関して、ピロリ菌由来病原タンパク質の血中エクソソーム中での存在を明らかにし、組織輸送ナノキャリアとして可能性を提唱した(東大畠山教授との共同研究)。また、日本発のエバネッセント波を用いた蛍光励起検出法によるレクチンマイクロアレイを用いることでエキソソームの表面糖鎖を非破壊の状態で高感度に検出し、糖鎖とエキソソームの細胞取り込み機構との関連について検討し、細胞との相互作用や組織移行においてエキソソーム上の糖鎖が重要であることを示した。さらに、CD8陽性T細胞からのエクソソームが間葉系の細胞で構成されるがん間質の除去作用があり、がん細胞の悪性化や転移を抑える働きがあるという現象を初めて見出した(三重大珠玖教授グループ)。その際、エクソソーム中のmiRNAが重要な役割を果たしていることを明らかにし、T細胞由来エクソソームのがん組織ミクロ環境改変とがん免疫療法への応用研究を展開している。
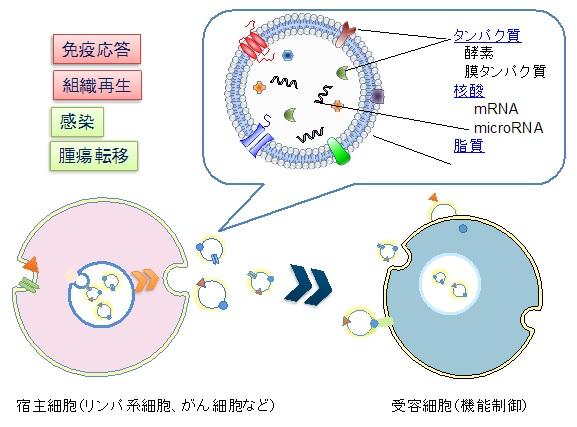
図3エクソソームの構造と機能
代表論文
- Y. Sato, K. Umezaki, S. Sawada, S. Mukai, Y. Sasaki, N. Harada, H. Shiku, K. Akiyoshi, Engineering hybrid exosomes by membrane fusion with liposomes, Scientific Reports, 6, 21933 (2016)
- A. Shimoda, K. Ueda, S. Nishiumi, N. Murata-Kamiya, S. Mukai, S. Sawada, T. Azuma, M. Hatakeyama, K. Akiyoshi, Exosomes as nanocarriers for systemic delivery of the Helicobacter pylori virulence factor CagA, Scientific Reports, 6, 18346 (2016)
- F. Momose, N. Seo, Y. Akahori, S. Sawada, N. Harada, T. Ogura, K. Akiyoshi, H. Shiku, Guanine-Rich Sequences Are a Dominant Feature of Exosomal microRNAs across the Mammalian Species and Cell Types, PLOS ONE, 4, e0154134 (2016)
- A. Shimoda, Y. Tahara, S. Sawada, Y. Sasaki, K. Akiyoshi, Glycan profiling analysis using evanescent-field fluorescence-assisted lectin array: Importance of sugar recognition for cellular uptake of exosomes from mesenchymal stem cells, Biochemical and Biophysical Research Communications, 491, 701-707 (2017).
- N. Seo, Y. Shirakura, Y. Tahara, F. Momose, N. Harada, H. Ikeda, K. Akiyoshi, H. Shiku, Activated CD8+ T cell extracellular vesicles prevent tumour progression by targeting of lesional mesenchymal cells, Nature Communications, 9, Doi: 10.1038/s41467-018-02865-1 (2018)