- JST トップ
- /
- 戦略的創造研究推進事業
- /
 ERATO
ERATO- /
- 研究領域の紹介/
- 終了領域/
- 水島細胞内分解ダイナミクスプロジェクト
水島細胞内分解ダイナミクスプロジェクト

研究総括 水島 昇
(東京大学 大学院医学系研究科 教授)
研究期間:2017年10月~2024年3月
※追加支援期間(ノーコストエクステンション型)の枠組みにより当初研究期間を(1年)延長し、2024年3月まで実施。
グラント番号:JPMJER1702
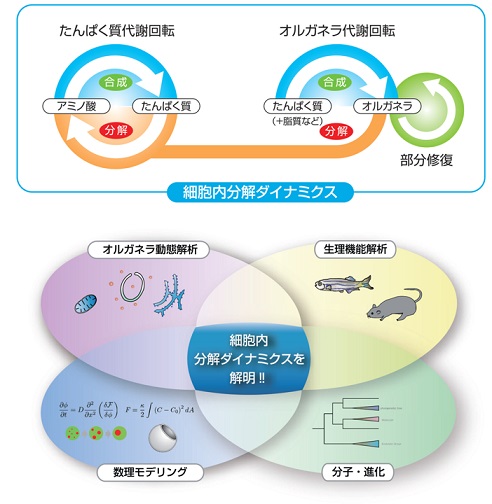
細胞内ではたんぱく質やオルガネラなどの合成と分解が絶えず起こっており、このダイナミックな代謝回転は、細胞恒常性、分化、環境適応などに重要です。主要な分解経路のひとつであるオートファジーは多くの真核生物に備わっているシステムで、たんぱく質だけでなくオルガネラのようなより大きな標的も分解します。オートファジーは基本的には非選択的な分解系ですが、一部の標的については選択的に分解することもできます。しかし、オートファジーによる分解の体系的および定量的理解はいまだ不十分です。オートファジーは老化やヒト疾患とも関係しうるため、これまで以上に深い理解が求められています。
本プロジェクトでは、オートファジーによるたんぱく質とオルガネラの分解を中心に、オートファジーの革新的定量解析法開発、新規オルガネラ単離技術開発、脊椎動物での細胞内分解の意義の包括的理解、数理・物理学的手法を用いたオートファジー過程のモデル化、分子進化的視点に基づいたオートファジー機構の理解を目指します。これらの技術開発や解析は、細胞生物学、細胞生理学を中心とした幅広い基礎研究分野への波及効果とともに、細胞内代謝回転が関連する疾患の理解や治療戦略への展開が期待されます。
研究グループ
・オルガネラ動態解析グル-プ
・生理機能解析グル-プ
・数理モデリンググル-プ
・分子・進化グループ
研究成果の概要
細胞内の主要な機能的構成因子であるタンパク質やオルガネラは、ダイナミックな合成と分解による代謝回転(turnover)によって恒常性が維持されている。そこで、本プロジェクトではオートファジーに焦点を当てた細胞内分解ダイナミクスの解明と、オートファジーを超えた細胞内分解研究の開拓を目的とした。第一に、オルガネラの定量的解析に最適な解析法の開発と、細胞や動物個体でのオートファジーの活性評価法の開発を行った。第二に、マウスやゼブラフィッシュなどのモデル動物を用いてオートファジーの生理機能を解明し、さらに水晶体におけるオートファジー非依存的な細胞内大規模分解機構を明らかとした。第三に、数理・物理のアプローチによりオートファジーにおける複雑な膜動態や基質の取り囲みを説明しうるモデルを構築し、それらの物理学的基盤についての知見を深めた。第四に、新規オートファジー関連遺伝子の探索や、分子進化的考察に基づくオートファジー関連因子の進化的変遷や多様性についても明らかとした。
本プロジェクトでは、異分野融合研究を展開することでオートファジー研究の新分野を切り拓くことができた。
研究成果
細胞内分解ダイナミクスに関連する新規計測技術の開発
細胞内分解に関する革新的計測技術の開発を目的として、サイズが小さく細胞内に多数分散して存在するオルガネラの動態を高解像度でかつ三次元的に解析できる技術基盤の確立と、オルガネラ粒子の多変量解析法の確立を行った。さらに、これまで以上に定量的で高感度な、細胞・動物個体内でのオートファジー活性評価法も開発した。
細胞内オルガネラの形成・分解のダイナミクスや、それらの相互関係を定量的に解析するために、走査型電子顕微鏡法(SEM)を用いた広域三次元電子顕微鏡法および光-電子相関顕微鏡法(Correlative Light and Electron Microscopy, CLEM)を確立した。この3D-CLEM法は、数個の細胞を含む広い範囲の三次元超微細形態情報を高解像度かつ分子局在情報付きで取得できる手法である。本手法により、形成中のオートファゴソームと他のオルガネラとの接触や、オートファゴソームが囲い込むオルガネラの種類に関する網羅的な情報の取得に成功した。さらに、本法は、本プロジェクト内だけではなく、他の研究室との共同研究にも用いられ、多数の研究成果に貢献した。
オルガネラ動態の全体像を定量的かつ統合的に理解するために、オルガネラ粒子マルチパラメーター解析法の開発を行った。本手法によって、蛍光スペクトルイメージングにより取得した最大8次元情報に次元削減法や混合ガウスモデルを適用することで観察対象とするオルガネラの動態を二次元平面図上で表現した”オルガネラマップ”を作製することができる。これにより、エンドサイトーシスなどの動的なプロセスを対象とするオルガネラ動態を二次元平面図上で表現し、直感的に理解することができるようになった。
オートファジーの研究を進めるにはオートファジー活性の定量が不可欠であるが、これまでに哺乳類細胞で開発された手法は手順が煩雑なうえに、定量性や検出感度が不十分であった。そこで、HaloTagを用いて、従来法に比べて定量性、感度、客観性などに優れた革新的オートファジー活性定量法を開発した。本手法を用いることでこれまで検出できなかったオートファジー遺伝子の疾患変異の解析などが可能となり、ヒト神経疾患の一つであるβ-propeller protein-associated neurodegeneration(BPAN)に関連するオートファジー関連タンパク質WIPI4の各変異の意義を解析することができた。
本プロジェクトで開発した以上の方法は、本プロジェクト内の研究だけではなく、今後の細胞内分解やオルガネラ動態解析に普遍的な有用性をもつ革新的計測技術あると考えられる。
代表論文
- Maeda, S., Yamamoto, H., Kinch, N. L., Garza, C.M., Takahashi, S., Otomo, C., Grishin,V. N., Forli,S., Mizushima, N. *Takanori Otomo. Structure, lipid scrambling activity and role in autophagosome formation of ATG9A. Nat. Struct. Mol. Biol.27:1194-1201 DOI: 10.1038/s41594-020-00520-2
- Yim, W.W., *Yamamoto, H., *Mizushima, N. A pulse-chasable reporter processing assay for mammalian autophagic flux with HaloTag. eLife 11:e78923 (2022)
- Takahashi, S., Saito, C., *Koyama-Honda I., *Mizushima, N. Quantitative 3D correlative light and electron microscopy of organelle association during autophagy. Cell Struct Funct. 47:89-99 (2022) doi: 10.1247/csf.22071
- Shimizu, T., Tamura, N., Nishimura, T., Saito, C., Yamamoto, H., *Mizushima. N., Comprehensive analysis of autophagic functions of WIPI family proteins and their implications for the pathogenesis of β-propeller associated neurodegeneration. Hum Mol Genet. 2023 Aug 7;32(16):2623-2637. doi: 10.1093/hmg/ddad096.
- Kurikawa, Y., *Koyama-Honda, I., Igarashi, K., Tamura, N., Koike, S., *Mizushima, N. Organelle landscape analysis using a multi-parametric particle-based method. bioRxiv 2023 doi:10.1101/2023.09.25.559448
細胞内分解の生理機能解析
オートファジーは細胞質成分を非選択的に分解するだけではなく、変性タンパク質、損傷オルガネラ、細胞内病原体などを選択的に識別して分解することもできる。そこで、この選択的オートファジーに関与するアダプタータンパク質の網羅的探索を行った。その結果、オートファジーによる小胞体の分解に重要な小胞体膜貫通タンパク質TEX264を同定し、カゼインキナーゼによるTEX264のリン酸化がオートファジーによる小胞体の分解に必要であることも明らかとした。さらに、オートファジーによる小胞体の分解に関与する別のアダプターであるCCPG1が小胞体内部の変性タンパク質を感知して、小胞体の外側のオートファゴソームに情報を伝えていることも見出し、小胞体品質管理機構への理解が大きく進んだ。また、一次繊毛形成に関与するオートファジーアダプタータンパク質としてNEK9を同定し、ミオシン重鎖MYH9のオートファジーによる選択的分解を制御していること、この機構が哺乳類などの陸上脊椎動物における腎臓の陸上生活への適応に重要であった可能性が見出された。
ゼブラフィッシュを用いて主要なオートファジー関連因子欠損体を網羅的に作製し表現型を比較解析した結果、オートファジーが浮袋の上皮細胞中のラメラ体の成熟とサーファクタントの十分な産生に必要であることを見出し、脊椎動物におけるオートファジーの新規機能を発見することができた。さらに、主要なオートファジー関連因子の一つである小胞体膜タンパク質VMP1が、リポタンパク質の小胞体膜から小胞体内腔への離脱に必要であるというオートファジー非依存的機能を有することも明らかとした。
非オートファジー分解系としては、眼の水晶体の細胞の成熟過程で起きる核やミトコンドリアなどの大規模オルガネラ分解に関するメカニズムを調べ、実行因子としてサイトゾルリパーゼであるPLAATファミリーホスホリパーゼを同定した。本研究は、その現象が発見されて以来100年以上にわたりほとんど未解明であった水晶体のオルガネラ分解のメカニズムを解明し、オートファジーの枠組みを超える新規の細胞内分解系の存在を示した。
代表論文
- Chino, H., Hatta, T., Natsume, T., *Mizushima, N. Intrinsically disordered protein TEX264 mediates ER-phagy. Mol. Cell 74: 909-921 (2019), DOI: 10.1016/j.molcel.2019.03.033.
- Morishita, H., Zhao, Y.G., Tamura, N., Nishimura, T., Kanda, Y., Sakamaki, Y., Okazaki, M., Li, D., *Mizushima, N. A critical role of VMP1 in lipoprotein secretion. eLife 8:e48834 (2019), DOI: 10.7554/eLife.48834
- Morishita H., Kanda, Y., Kaizuka, T., Chino, H., Nakao, K., Miki, Y., Taketomi, Y., Guan, J., Murakami, M., Aiba, A., *Mizushima. N. Autophagy is required for maturation of surfactant-containing lamellar bodies in the lung and swim bladder. Cell Rep. 33, 108477 (2020)
- *Morishita, H., Eguchi, T., Tsukamoto, S., Sakamaki, Y., Takahashi, S., Saito, C., Koyama-Honda, I., *Mizushima, N. Organelle degradation in the lens by PLAAT phospholipases. Nature. 592:634-638 (2021)
- Yamamoto, Y., Chino, H., Tsukamoto, S., Ode, K,L., Ueda, H.R., *Mizushima, N. NEK9 regulates primary cilia formation by acting as a selective autophagy adaptor for MYH9/myosin IIA. Nat. Commun. 12:3292 (2021)
- Chino, H., Yamasaki, A., Ode, K.L., Ueda, H.R., *Noda, N.N., *Mizushima, N. Phosphorylation by casein kinase 2 ensures ER-phagy receptor TEX264 binding to ATG8 proteins. EMBO Rep. 23:e54801 (2022).
- Ishii, S., Chino, H., Ode, K.L., Kurikawa, Y., Ueda, H.R., Matsuura, A., *Mizushima, N., *Itakura, E. CCPG1 recognizes ER luminal proteins for selective ER-phagy. Mol Biol Cell. 34:ar29 (2023) doi: 10.1091/mbc.E22-09-0432
数理モデル・シミュレーションとの融合研究
オートファゴソームの形成過程では、隔離膜が成長とともに大規模に変形する。しかしながら、それがどのような物理学的基盤により制御されているのかはほとんど不明であった。そこで私たちは、数理モデルを構築することによって、オートファゴソームの形態変化を理解することを試みた。オートファゴソーム形成における膜変形と、膜の曲率を認識する曲率因子の分布変化を考慮した数理モデルを構築したところ、それは実際の細胞のイメージングで観察される隔離膜の形態変化を定量的に再現した。さらに、膜構造全体を楕円体に近似せずに構築した、膜の曲げ弾性エネルギーに基づく物理モデルは、三次元電子顕微鏡法による網羅的な解析で得られたオートファゴソーム形成過程の「極初期カップ」、「初期カップ」、「中期カップ」、「後期カップ」の4つの形態変化を定量的に再現した。
細胞内でタンパク質は液-液相分離を起こして球状の「液滴」を生じることがある。この液滴がオートファジーによって分解されることは知られていたが、その物理的背景については不明であった。そこで、試験管内再構築実験、生細胞観察と数理モデルを用いてオートファゴソーム膜と液滴の相互作用を解析した。その結果、オートファゴソーム膜が液滴を隔離する際に、オートファゴソーム膜の曲げ弾性エネルギーに加え、液滴とオートファゴソーム膜間のウェッティング効果が寄与していることを明らかにした。
ミトコンドリアのオートファジーによる選択的分解であるマイトファジーについては、その誘導時に、オートファジーアダプタータンパク質がミトコンドリア上でシート状液滴を形成し、その流動性が効率的なマイトファジーに重要であることを見出した。さらに、数理モデルの構築により、アダプターのシート状液滴は、アダプターの自己相互作用、ユビキチン結合、隔離膜結合を介して形成されることを示唆した。これらの成果は、液滴と膜のウェッティング現象が細胞内でおこっていることを示したという点からも新しい展開であると言える。
代表論文
- Sakai, Y., Koyama-Honda, I., Tachikawa, M., Knorr, R.L., *Mizushima, N. Modeling membrane morphological change during autophagosome formation. iScience 23:101466 (2020), DOI: 10.1016/j.isci.2020.101466.
- Agudo-Canalejo, J., Schultz, S.W., Chino, H., Migliano, S., Saito, C., Koyama-Honda, I., Stenmark, H., Brech, A., May, A.I., Mizushima, N., *Knorr, R. L. Wetting regulates autophagy of phase separated droplets and the cytosol. Nature 591:142-146 (2021)
- Yang, Z., Yoshii, S.R., Sakai, Y., Chino, H., Knorr, R.L., *Mizushima, N. Autophagy adaptors mediate Parkin-dependent mitophagy by forming sheet-like liquid condensates. bioRxiv 2023.09.11.557117; doi: https://doi.org/10.1101/2023.09.11.557117
- Sakai, Y., Takahashi, S., Koyama-Honda, I., Saito, C., *Mizushima, N. Experimental determination and mathematical modeling of standard shapes of forming autophagosomes. Nat Commun 15, 91 (2024). doi: 10.1038/s41467-023-44442-1.
細胞内分解関連因子の分子・進化研究
既存のモデル生物に加え、非モデル生物までを含めたトランスクリプトームデータを用いて約100種の代表的真核生物のタンパク質配列データベースを独自に構築し、真核生物全体におけるオートファジー関連(ATG)因子の進化的多様性を解析した。その結果、発見以来20年間にわたって必須と考えられてきたATG12-ATG5の共有結合が非共有結合性へと縮小進化していること、この縮小進化が真核生物内で独立して頻繁に起こっていたことを明らかにした。
また、ヒト全遺伝子を対象とした網羅的かつ効率的なCRISPRスクリーニングを実施し、出芽酵母には存在しない新規オートファジー因子TMEM41Bを発見した。さらに、構造情報も加味した最新の検索アルゴリズムを用いて、原核生物を含めたリモートホモログの探索も行った結果、TMEM41BはDedAドメインと命名した2つの典型的膜貫通領域と2つの向き合ったリエントラントループからなることが示唆され、イオンまたは脂質のトランスポーターとして機能する可能性を示した。
細胞内の鉄貯蔵タンパク質であるフェリチンの分解にNCOA4が関わることが知られていたが、私たちはフェリチンがNCOA4依存的に液-液相分離による液滴を形成し、TAX1BP1がこのフェリチン液滴のアダプターとしてマクロオートファジーとミクロオートファジーによる分解を引き起こすことを明らかにした。
オートファジーを越える発見として新しいユビキチン結合を見出した。これまでユビキチンはタンパク質のみと共有結合して、そのタンパク質の分解や性質の変化をもたらすシグナルとして働くと考えられてきた。しかし、私たちはエンドソームや液胞(動物細胞ではリソソームに相当)などの細胞小器官の膜に存在するリン脂質のひとつであるホスファチジルエタノールアミンがユビキチン化されていることを発見した。さらに、ユビキチン活性化酵素Uba1、ユビキチン結合酵素Ubc4/5、ユビキチンリガーゼTul1、脱ユビキチン化酵素Doa4がホスファチジルエタノールアミンのユビキチン化と脱ユビキチン化に関与すること、ユビキチン様タンパク質であるNEDD8やISG15もリン脂質と共有結合することなどを明らかにした。
代表論文
- Morita, K., Hama, Y., Izume, T., Tamura, N., Ueno, T., Yamashita, Y., Sakamaki, Y., Mimura, K., Morishita, H., Shihoya, W., Nureki, O., Mano, H., *Mizushima, N. Genome-wide CRISPR screen identifies TMEM41B as a gene required for autophagosome formation. J. Cell Biol. 217: 3817-3828 (2018), DOI: 10.1083/jcb.201804132
- Pang, Y., Yamamoto, H., Sakamoto, H., Oku, M., Mutungi, J.K., Sahani, M.H, Kurikawa, Y., Kita, K., Noda, N.N., Sakai, Y., Jia, H., *Mizushima, N. Evolution from covalent conjugation to non-covalent interaction in the ubiquitin-like ATG12 system. Nat. Struct. Mol. Biol. 26: 289-296 (2019), DOI: 10.1038/s41594-019-0204-3
- Okawa, F., Hama, Y., Zhang, S., Morishita, H., Yamamoto, H., Levine, T.P., *Mizushima, N. Evolution and insights into the structure and function of the DedA superfamily containing TMEM41B and VMP1. J. Cell Sci. 134:jcs255877 (2021)
- Zhang, S., Yazaki, E., Sakamoto, H., Yamamoto, H., *Mizushima, N. Evolutionary diversification of the autophagy-related ubiquitin-like conjugation systems. Autophagy 18:2969-2984 (2022). doi: 10.1080/15548627.2022.2059168.
- Sakamaki, J.I., Ode, K.L., Kurikawa,Y., Ueda, H.R., Yamamoto, H., *Mizushima, N. Ubiquitination of phosphatidylethanolamine in organellar membranes. Mol. Cell 82: 3677-3692 (2022). DOI:10.1016/j.molcel.2022.08.008
- Ohshima, T., Yamamoto, H., Sakamaki, Y., Saito, C., *Mizushima, N. NCOA4 drives ferritin phase separation to facilitate macroferritinophagy and endosomal microferritinophagy. J Cell Biol. 221:e202203102 (2022).









