- 【烏山チーム】「アレルギーを抑える新たな仕組みを発見」Immunity 2013
- 【木梨チーム】「自己免疫病発症の新たなメカニズムを発見-自己反応性T細胞の除去に細胞接着分子の制御が関与-」Nature Communications 2012
9.アレルギー・自己免疫疾患制御への取組み
アレルギーは生体にとって無害な異物(アレルゲン)がIgEと呼ばれる抗体に結合し、これら抗原抗体複合体によって肥満細胞が刺激されると、肥満細胞から炎症の元となる化学物質が放出され、アレルギー症状が誘発されます。一方、自己免疫疾患はさまざまな免疫細胞が自分の体を攻撃することで発症する疾患と考えられています。近年の研究により、これら免疫疾患には、他の様々な要因も関与していることが次第に明らかにされて おり、免疫疾患の全容解明とともに、新たな創薬標的の出現にも期待が掛けられています。
烏山チームは、アトピー性皮膚炎モデルマウスを用いて、従来炎症の悪化に関わるとされていたマクロファージの中に、炎症を抑制するM2細胞群が存在することを明らかにしています。木梨チームは、免疫系細胞の細胞間接着の制御に関わるMst1キナーゼを同定し、Mst1欠損マウスにおいて、胸腺でのT細胞の負の選択に異常が起こり、自己免疫疾患の発症がみられることを明らかにしています。
【烏山チーム】「アレルギーを抑える新たな仕組みを発見」Immunity 2013
<ポイント>
- アレルギー性の炎症を誘導する仕組みに比べ抑える仕組みは十分な解析が進んでいない。
- 「アレルギーを悪化させる細胞(火付け役)」を「アレルギーを抑える細胞(火消し役)」に変身させるユニークな仕組みがあることを発見。
- アトピー性皮膚炎などのアレルギー疾患に対する新たな治療法の開発に期待。
近年、先進諸国においてアレルギー患者数が年々増加し、日本でも人口の3割近くを悩ます国民的な病気としてアレルギーが大きな社会問題となっています。しかし、アトピー性皮膚炎やぜんそくに代表される重篤なアレルギー疾患に関しては、発症・悪化のメカニズムなどを含め、根本的治療に向けた病態解明はまだ十分に進んでいません。
本研究グループはこれまでに、アトピー性皮膚炎の病態解明と新たな治療標的の探索を目的として、アトピー性皮膚炎に類似した慢性皮膚アレルギー炎症のモデルマウスを開発し、抗体の一種であるIgEと白血球の一種である好塩基球注1)がアレルギーの発症に深く関わっていることを明らかにしてきました。この慢性皮膚アレルギーモデルでは、好塩基球のほかにさまざまな種類の白血球が皮膚の炎症部位に集まっていますが、それぞれがアレルギー性炎症においてどのような役割を果たしているのかが、よく分かっていませんでした。
本研究グループは、慢性皮膚アレルギー炎症のモデルマウスで炎症部位に集まっている白血球を調べたところ、そのうち半数近くがマクロファージ注2)であることを見いだしました。これらは血中を循環している炎症性単球に由来し、血中から皮膚に浸み出した単球注3)が、マクロファージへと分化することが分かりました(図1)。このマクロファージの特徴を詳しく調べたところ、マクロファージの中でも2型マクロファージと呼ばれるものであることが明らかとなりました。炎症性単球は、その名が示す通り炎症を引き起こす細胞とされ、これまで炎症の誘導・悪化に関与すると考えられてきました。2型マクロファージもアレルギー炎症の誘導・悪化に寄与すると報告されていましたので、当初はこれらの細胞がアレルギー炎症の誘導に深く関わっていると予想しました。ところが、この炎症性単球が皮膚内に浸み出せないように遺伝子を操作したCCR2欠損マウス注4)では、予想に反して、炎症が軽快するのではなく、かえって悪化・長期化してしまいました。そこで、正常マウス由来の炎症性単球をこのCCR2欠損マウスに注射すると、炎症性単球が皮膚アレルギー炎症部位に浸み出して2型マクロファージへと成熟する結果、ひどかった炎症を抑えることを発見しました(図2)。さらなる解析から、好塩基球が産生するサイトカインの1つであるインターロイキン4(IL-4)が、皮膚に浸み出してきた炎症性単球に作用して、2型マクロファージへと変化させることも明らかとなりました(図1)。
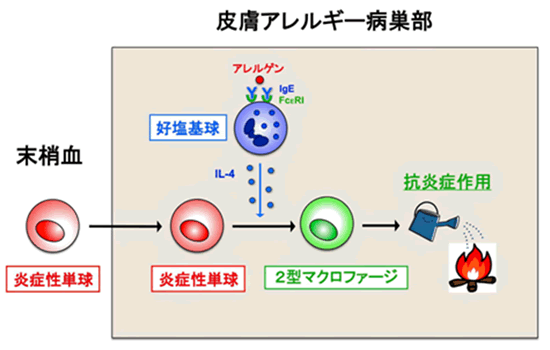
図1 アレルギーの火付け役(炎症性単球)から火消し役(2型マクロファージ)への変換
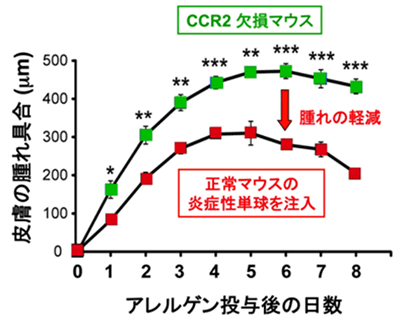
図2 炎症性単球がアレルギー炎症を抑制する~炎症の火付け役が火消し役に変化する
以上のように、本研究では、炎症性単球が血中から皮膚に浸み出した後に、好塩基球の産生するIL-4の影響を受けて2型マクロファージへと変化することで炎症を抑制させる能力を獲得して、アレルギー性炎症を抑え、アレルギーを終焉に向かわせるという新事実を世界に先駆けて発見しました。これまで、2型マクロファージの生い立ちに関しては、常在性単球からの生成経路と組織常在マクロファージからの生成経路の2つが知られていましたが、本研究で炎症性単球からの生成経路が存在することが判明するとともに、炎症性単球由来の2型マクロファージがアレルギーを抑制することが明らかとなりました(図3)。
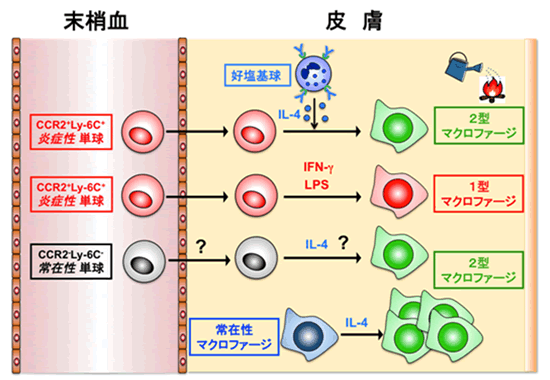
図3 2型マクロファージ生成の第3経路の発見
これまで、炎症性単球から1型マクロファージへの分化経路はよく知られていましたが、2型マクロファージの生成経路に関しては不明な点が多く残されていました。これまでに、常在性単球からの分化経路と常在性マクロファージからの生成経路が存在することが報告されていましたが、今回の研究で、炎症性単球から2型マクロファージが生成するという新たな経路が発見されました。
<用語解説>
- 注1) 好塩基球
- 血中を流れる白血球の約0.5%を占めるに過ぎない極少血球細胞。長年その存在意義が不明でしたが、最近の研究によりアレルギーの発症や寄生虫に対する生体防御に重要な働きをしていることが次第に分かってきました。
- 注2) マクロファージ
- 1型と2型に大別され、前者は結核など細胞内寄生細菌の排除に、後者は寄生虫の排除や組織修復に重要な働きをしているといわれています。
- 注3) 単球
- 血中を流れる白血球の1つで、皮膚などの末梢組織に入った後にマクロファージ(注3参照)や樹状細胞へと分化し、末梢組織での免疫反応に関わります。
- 注4) CCR2欠損マウス
- ケモカイン受容体CCR2の遺伝子を欠損したマウスで、炎症性単球の遊走に必要なCCR2を持たないため、このマウスでは炎症性単球の末梢組織への浸潤が起こりません。
<共同研究者>
本研究は、金沢大学 がん進展制御研究所の向田 直史 教授の協力を得て行われました。
<原論文情報>
“Inflammatory monocytes recruited to allergic skin acquire an anti-inflammatory M2 phenotype via basophil-derived interleukin-4”
(皮膚アレルギー病巣に浸潤してきた炎症性単球は、好塩基球由来のインターロイキン4の作用により炎症抑制能力を獲得する)
Immunity. 2013 Mar 21;38(3):570-80. doi: 10.1016/j.immuni.2012.11.014. Epub 2013 Feb 21.
Egawa M1, Mukai K, Yoshikawa S, Iki M, Mukaida N, Kawano Y, Minegishi Y, Karasuyama H.
【木梨チーム】「自己免疫病発症の新たなメカニズムを発見-自己反応性T細胞の除去に細胞接着分子の制御が関与-」Nature Communications 2012
<ポイント>
- 胸腺髄質上皮細胞の一部に存在する転写因子AireはTリンパ球の負の選択に関与する。
- Aireの異常で自己免疫疾患になることが明らかとなっているが、その仕組みは不明である。
- 接着制御因子Mst1がAire陽性細胞と抗原提示細胞の接着を促し、負の選択に重要なはたらきをしていることを発見
自己免疫病注1)はリンパ球が自己の組織に対して免疫反応を起こし、組織破壊を起こすことによって生じる疾患で、その多くは原因不明の難病に指定され、原因究明と治療法の確立が求められています。自己反応性のTリンパ球注2)は、Tリンパ球が様々な抗原に結合できるように胸腺注3)で成熟する過程で生じますが、大半は胸腺内で除去されます。その過程は負の選択と呼ばれ、これまで自己の組織に反応するTリンパ球は胸腺内で自己組織の抗原によって除去されることがわかっていましたが、そのしくみは不明なところが多く、近年明らかになりつつあります(吉村チームへリンク)。一方、細胞接着分子インテグリン注4)ファミリーに属するLFA-1 注5)は、リンパ球が血管内皮や抗原を提示する細胞に接着するときに必要であり、私たちはその接着の制御に低分子量G蛋白質注6)であるRap1 によるMst1 キナーゼと呼ばれる酵素の活性化が重要な役割をしていることを明らかにしていました。
Tリンパ球の分化は血液由来の少数の幹細胞が胸腺に移動することで始まり、成熟Tリンパ球の巨大なレパートリーが形成されます。胸腺の組織は皮質と髄質に分かれ、未熟なTリンパ球は胸腺の皮質から髄質へ移行しながら上皮細胞が提供する微小環境の影響を受けて成熟し、様々な抗原を認識するようになります。自己の抗原に反応するTリンパ球は主に髄質で自己の抗原に遭遇すると負の選択により、除去されます。胸腺の髄質の上皮細胞の一部では、転写調節因子Aire (autoimmune regulator)が末梢組織の抗原発現を調節することによって負の選択に関与しており、Aire の障害は多臓器の自己免疫病につながることがわかっていましたが、負の選択過程で具体的どのように関与しているのか明らかにされていませんでした。
木梨チームは接着制御分子注7)Mst1 を欠損したマウスを作製し、Mst1 を欠損すると負の選択に異常が起こり、加齢すると多臓器に及ぶ自己免疫病態が生じることを発見しました。さらに、胸腺髄質ではLFA-1 のリガンドであるICAM-1 注8)の発現が高く、特に上皮細胞の一部に高発現している細胞が点在していたことから、負の選択過程にLFA-1 とICAM-1 を介した接着過程が重要な役割を果たしていると予想しました。
そこで組織深部を見ることができる2 光子レーザー顕微鏡による胸腺組織の撮影を試みました。まず、モデル自己抗原(OVA 抗原)を胸腺で発現し、さらにAire 発現細胞が蛍光蛋白質GFP で可視化されたマウスの胸腺を400μmの厚さにスライスし、蛍光色素でラベルしたOVA 特異的な未熟T リンパ球をいれて観察する実験系を確立しました。生体内ではOVA 特異的な未熟Tリンパ球は負の選択により除去されます。観察の結果、OVA特異的未熟Tリンパ球は髄質に移行すると高速に移動し、Aire 陽性細胞に遭遇すると強く接着し、細胞の凝集塊を形成しながら活性化することがわかりました。しかしながら、Mst1が欠損すると髄質内での移動速度が低下するとともに、Aire 陽性細胞との接着が障害され、自己反応性のTリンパ球は胸腺で除去されず、末梢組織に移行して活性化していました。また、このOVA 特異的未熟Tリンパ球とAire 陽性細胞との接着過程にはLFA-1 とICAM-1 が必要であり、ICAM-1 を欠損すると自己反応性T リンパ球が除去されないことも明らかになりました。これらの結果からMst1はLFA-1/ICAM-1を介する接着を制御することによって自己反応性のT細胞を除去する過程に重要な働きをしていると考えられます。 今回の研究成果からインテグリン LFA-1 による接着制御が自己免疫病の発症防止に重要であることが明らかになりました。今後、これまで不明であった負の選択過程の具体的メカニズムを明らかにすることが可能になると考えられます。この研究では細胞死の過程までとらえることはできませんでしたが、現在、細胞死の可視化を実現することができるようになり、今後自己反応性T細胞が死ぬ過程を詳細にとらえることができるようになると予想されます。組織片で負の選択過程を再現することができれば、阻害剤や抗体などの負の選択に対する効果を個体を用いることなく、直接判定することも可能になると考えられます。また、Mst1遺伝子変異によっておこるヒト免疫疾患が最近発見され、免疫不全と自己免疫病が複合した病態であることが報告されましたが、今回の研究によりその病態理解と治療に役立つと考えられます。
<参考図>
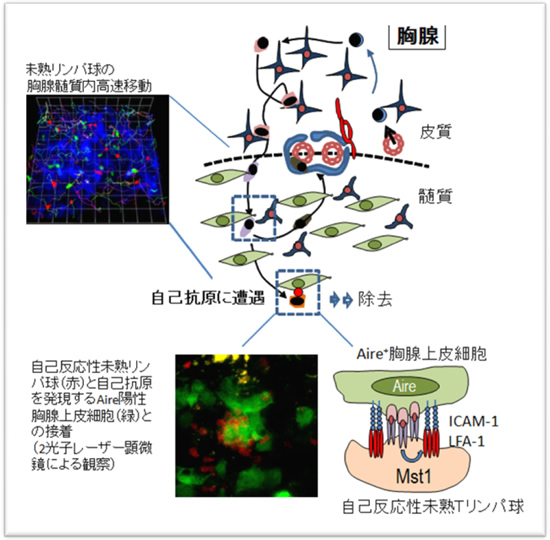
図:未熟Tリンパ球の胸腺内移動と自己抗原認識過程の模式図
<用語解説>
- 注1)自己免疫病
- 膠原病とも呼ばれ、全身性エリテマトーデス、慢性関節リュウマチ、シェーグレン症候群などがある。正常な免疫反応は異物と自己を区別して、病原微生物などを攻撃し排除するが、自己免疫病では自己の組織に対して免疫反応がおこり、組織破壊などによって病気がおこる。
- 注2)Tリンパ球
- リンパ球の一種で、免疫応答の司令塔として機能する。
- 注3)胸腺
- T リンパ球が生まれる臓器で、心臓の上に位置している。Tリンパ球の幹細胞は骨髄で生まれ胸腺に移動し、未熟なTリンパ球(胸腺細胞という)に分化する。未熟Tリンパ球は増殖し分化すると多様なT細胞抗原受容体を発現するようになる。自己の組織に反応する抗原受容体を発現した未熟Tリンパ球は胸腺内で除去される(負の選択)。
- 注4)インテグリン
- 細胞に広く発現し、細胞どうし、あるいは細胞と細胞外マトリックスの接着を引き起こす細胞接着分子の一つのファミリー。
- 注5)LFA-1
- インテグリンに属する接着分子の一つ、リンパ球など免疫系細胞に発現する。
- 注6)低分子量G蛋白質
- GTP(グアノシン三リン酸)と結合し加水分解する一群の酵素あるいはタンパク質であるGTPアーゼのうち、20~30KDa程度の小さな分子量のもの。
- 注7)接着制御分子
- 多細胞生物の細胞膜上には多くの膜たんぱく質(接着分子)が存在し、細胞同士を接着させ、細胞間の相互作用に関与している。さまざまな免疫反応はその時々に必要な接着構造が接着制御分子によって制御されている。
- 注8)ICAM-1
- 血管内皮や免疫細胞に発現する接着分子。LFA-1 はICAM-1 に結合することによって接着を引き起こす。
<共同研究者>
本研究は関西医科大学 植田祥啓、北里大学 片桐晃子と共同で行ったものです。
<原論文情報>
“Mst1 regulates integrin-dependent thymocyte trafficking and antigen recognition in the thymus”
(Mst1 は胸腺内のインテグリン依存性の胸腺細胞移動と抗原認識を調節する)
Nat Commun. 2012;3:1098. doi: 10.1038/ncomms2105.
Ueda Y1, Katagiri K, Tomiyama T, Yasuda K, Habiro K, Katakai T, Ikehara S, Matsumoto M, Kinashi T.

