- 【高井チーム】「自己免疫疾患の増悪に関与する免疫細胞をPirBが抑制する仕組みを解明」Blood 2012
- 【岡崎チーム】「さまざまな自己免疫疾患の発症を制御するタンパク質を発見」JEM 2011
- 【渋谷チーム】「敗血症の発症に関与する免疫細胞膜たんぱく質を発見」JEM 2012
6. 免疫系受容体分子を介した疾患制御のしくみ
免疫系受容体にはすでに述べたB細胞抗原受容体やT細胞抗原受容体の他にもにも様々な種類の受容体が存在し、それぞれが免疫系の調節に関わっています。これら受容体に結合する物質(リガンド)を特定することは、医薬品の開発に直結しますので、大変重要です。最近は免疫系を活性化させる活性化受容体と抑制化させる抑制化受容体がペアになったペア型受容体など、様々な種類の受容体研究が盛んになり、それらの役割が次々に明らかになってきました。
高井チームは、抑制性受容体であるPirBが抗原提示細胞に対して抑制的に作用することによって、自己免疫疾患の制御に関わっていることを明らかにしています。岡崎チームは、自らが遺伝子単離したPD-1が抑制性受容体であることから、PD-1と協調して自己免疫疾患の発症に関わる新たな分子LAG-3を同定しています。渋谷チームは、肥満細胞による敗血症の抑制作用に抑制性受容体であるMAIR-1が関わっていることを見出しています。
【高井チーム】「自己免疫疾患の増悪に関与する免疫細胞をPirBが抑制する仕組みを解明」Blood 2012
<ポイント>
- 形質細胞様樹状細胞はIFN-αを産生してウイルス排除を担う一方で、自己免疫疾患の発症にも関与している。
- 抑制性受容体のPirBがpDCの分化やpDCにおけるIFN-αの産生を抑制することを解明。
- 自己免疫疾患の新規治療法確立に期待。
形質細胞様樹状細胞(以下pDC)は、ウイルス感染時に活性化し、サイトカインの一つであるIFN-αを大量に産生し、ウイルス排除を担う免疫細胞です。一方、全身性エリテマトーデスなどの自己免疫疾患ではIFN-αが病態形成や増悪の一因と考えられており、pDCの制御機構を明らかにすることは治療戦略上、重要な課題とされています。
マウスのPaired IgLR(PIR)は活性化シグナルを伝達するPIR-Aと、逆に抑制性シグナルを伝達するPIR-Bのペアからなり、Immunoglobulin (Ig)-like receptor(IgLR)という受容体分子群に属しています(図1)。IgLRは免疫機構の調節に重要な役割を担うことが明らかにされています。高井チームは多様な分子を認識して免疫細胞の活性化を抑制する受容体タンパクであるPirBのさまざまな機能を明らかにしており、PirBが欠損するとB細胞や樹状細胞のシグナル伝達が撹乱され、その免疫応答はTh2型に著しく偏ることが示されました。
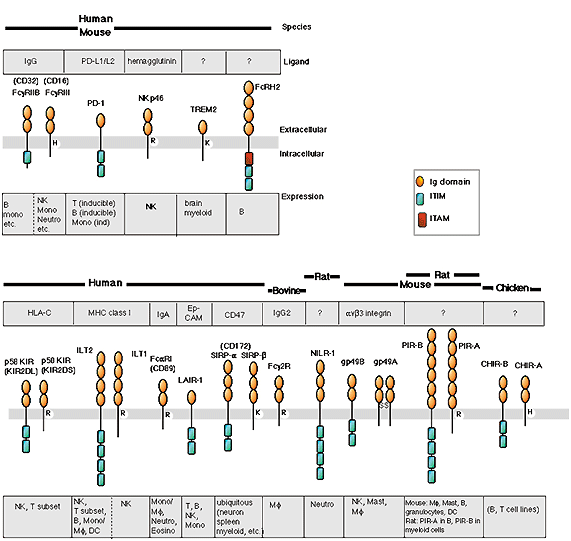
図1 IgLR分子群の構造
高井チームは2012年新たに、PirBがpDCの分化とIFN-α産生の制御に重要な役割を担うことを解明しました。pDCは骨髄細胞からサイトカインFlt3-Lによって誘導されますが、PirBは未熟pDCから成熟pDCへの分化過程で発現が上昇し、pDCの分化を抑制していることがわかりました。
一方、pDCは細胞内ウイルスセンサーであるToll様受容体の刺激によりIFN-αを大量に産生しますが、それには分泌されたIFN-αが、分泌した樹状細胞自身に作用するオートクライン効果が必須であることが報告されています。今回の研究では、PirBがこのオートクライン効果を抑制することにより、pDCのIFN-αの産生を抑制していることを明らかにしました。
PirBを標的としてpDCの作用を抑制することで、自己免疫疾患の発症をコントロールする方法や薬剤の開発が期待されます。
<原論文情報>
Mitsuhashi Y. et. al.“Regulation of plasmacytoid dendritic cell responses by PIR-B”
Blood 12(16):3256
【岡崎チーム】「さまざまな自己免疫疾患の発症を制御するタンパク質を発見」JEM 2011
<ポイント>
- PD-1という抑制性免疫受容体が欠損すると自己免疫疾患を起こすことが知られていた。
- PD-1と協調して自己免疫疾患の発症に関与する分子LAG-3を同定。
- 免疫疾患やがん、感染症などの新規治療法に期待。
人口の5%が何らかの自己免疫疾患注1)にかかっていると言われていますが、その多くについて効果的な根治療法はなく、対症療法による治療が中心となっています。効果的な根治療法の開発には、疾患がどのように発症するのかを解明することが不可欠ですが、ほとんどの自己免疫疾患は多くの遺伝子が関与するため、原因遺伝子を特定することは極めて困難です。また、自己免疫疾患の制御に関与する遺伝子がいくつか報告されているものの、それらがどのように協調して働き、実際に自己免疫疾患の発症を制御しているかはほとんど解明されていません。
岡崎チームはこれまでにマウスリンパ球の膜表面にあって免疫反応を抑制する「LAG-3」と呼ばれるたんぱく質を働かなくしたマウスが、さまざまな自己免疫疾患を発症することを発見し、その解析を行いました。例えば、BALB/cという本来正常な系統のマウスでPD-1を欠損させる(BALB/c-PD-1欠損マウス)と、自己免疫性の拡張型心筋症や胃炎を自然発症します(図1)。もし、PD-1と協調して自己免疫疾患の発症を制御する分子が特定できれば、自己免疫疾患の発症を制御する多因子のネットワークシステムが解明され、新規の診断法・治療法の開発につながるものと期待されています。
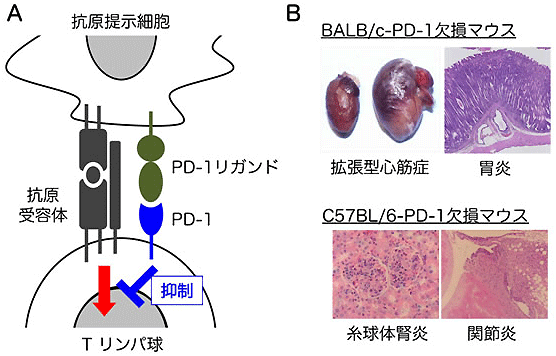
図1 免疫補助受容体PD-1を欠損させたマウスは自己免疫疾患を発症する
B: PD-1を欠損させたマウスは、BALB/cという系統では自己免疫性の拡張型心筋症や胃炎を自然発症し、C57BL/6という系統では、自己免疫性の糸球体腎炎や関節炎を自然発症する。
自己免疫疾患を発症した人間やモデル動物では、親和性成熟とクラススイッチ注2)という2種類の機能変化を受けた抗体が高頻度に検出されます。そこで本研究グループは、自己免疫疾患を発症するPD-1欠損マウスとNODマウス(non-obese diabetic mouse)注3)とを、この2種類の機能変化に必須の酵素AID(Activation-induced cytidine deaminase)注4)を欠損させたマウス(AID欠損マウス)とそれぞれ交配させると、抗体の機能変化が起こらなくなるので、自己免疫疾患の症状が好転するのではないかと予測しました。しかし実際には、PD-1・AID二重欠損マウスは、PD-1欠損マウスでは見られない激しい心筋炎を自然発症し、NOD-AID欠損マウスはNODマウスよりも早期に1型糖尿病注5)を発症しました(図2)。そこで、AIDの機能不全が自己免疫疾患を誘導する可能性をさまざまな角度から検証しましたが、その証拠は得られませんでした。
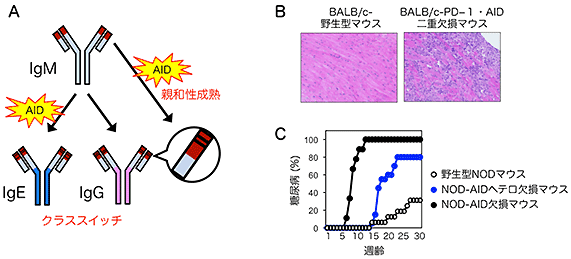
図2 AID欠損は自己免疫疾患を悪化させた
B: BALB/c系統のPD-1欠損マウスにAID欠損を追加すると、激しい心筋炎を自然発症した。
C: NODマウスにAID欠損を導入すると、1型糖尿病の発症が大幅に促進された。
反対に、AID遺伝子を欠損しているものの、全く自己免疫疾患を発症しないマウスが産まれたことから、これらの影響はAIDの機能不全によるものではなく、AID遺伝子の近くに存在する別の遺伝子の変異、あるいはマウスの系統による差の影響である可能性が高くなりました。そこで、AID遺伝子座の近くに存在し、自己免疫疾患を誘導する遺伝素因を「aida変異」、aida変異を有するマウスを「aidaマウス注6)」と命名しました。
自己免疫疾患を発症する(aida変異を持つ)PD-1・AID二重欠損(aida)マウスと、自己免疫疾患を発症しない(aida変異を持たない)PD-1・AID二重欠損マウスの染色体を詳細に比較した結果、aidaマウスにはAID遺伝子の近くに存在するLAG-3という免疫細胞の表面に発現するたんぱく質の遺伝子に変異があり、その機能が欠失していることを発見しました(図3)。
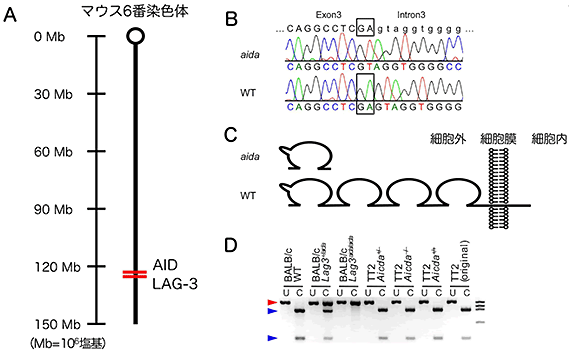
図3 当初AID欠損の影響と考えられた自己免疫疾患の悪化は、LAG-3遺伝子に偶然導入された突然変異によるものであった
B: AID欠損マウスのLAG-3遺伝子は、塩基が2つ欠失していた。
C: LAG-3は、細胞膜を貫通する膜たんぱく質であるが、この欠失変異により、不完全なたんぱく質しかできなくなった。
D:この欠失変異は、AID欠損マウスをBALB/c系統に戻し交配する過程で、偶然導入された突然変異であった。
LAG-3遺伝子の変異はAID欠損マウスの作製に使用したES細胞では認められなかったため、系統による差ではなく、AID欠損マウスをBALB/c系統に戻し交配注7)する過程で偶然起こった突然変異であることが分かりました。その後、LAG-3、PD-1、AIDの欠損をさまざまに組み合わせて発症する自己免疫症状を解析したところ、BALB/c系統においてはLAG-3単独の欠損では自己免疫疾患を発症しませんが、PD-1欠損と協調して激しい心筋炎を発症させること、NODマウスではLAG-3単独の欠損で1型糖尿病の発症を悪化させることなど、LAG-3が与えるさまざまな影響が分かりました。また、PD-1とAIDを欠損させたところ胃炎や拡張型心筋症を発症しなかったことから、PD-1欠損マウスが発症する胃炎や拡張型心筋症には、抗体分子の親和性成熟とクラススイッチが必須であることも分かりました。一方、PD-1・LAG-3二重欠損マウスが発症する激しい心筋炎やNOD-LAG-3欠損マウスが発症する1型糖尿病には、抗体分子の親和性成熟とクラススイッチは不要であり、これらのことから、自己免疫疾患の種類によって抗体分子の親和性成熟とクラススイッチの関与が異なることが明らかになりました。このように、当初AIDの欠損によると考えられていた自己免疫症状の悪化はLAG-3の欠損によるものでした。
さらに、Tリンパ球の活性化におけるLAG-3とPD-1の機能を解析し、PD-1とLAG-3が協調的に働き、リンパ球の増殖やサイトカインの産生を抑制することも解明しました(図4)。
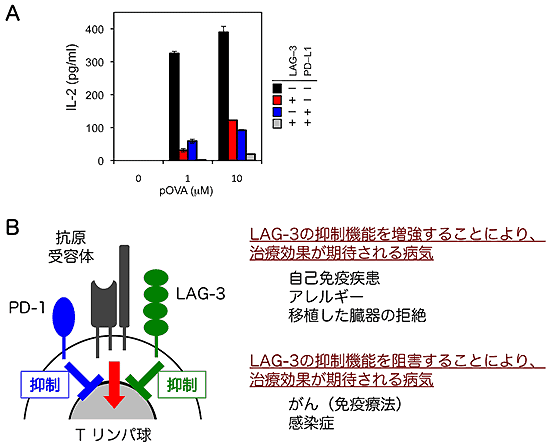
図4 LAG-3はPD-1と協調してTリンパ球の自己に対する反応を抑制する
B: LAG-3とPD-1は活性化したTリンパ球の表面に発現し、抗原受容体刺激を抑制する。LAG-3の抑制機能を増強する薬剤が開発されれば、自己免疫疾患やアレルギーの治療、臓器移植時の免疫抑制剤として利用できる可能性がある。また、LAG-3の抑制機能を阻害する薬剤が開発されれば、がんの免疫療法や、感染症の治療に利用できる可能性がある。
このように、LAG-3は自己免疫疾患の発症制御において極めて重要な役割を果たしますが、単独で欠損させただけでは大きな影響が確認されていなかったため、自己免疫疾患における役割ははっきりとしていませんでした。LAG-3欠損がPD-1欠損と偶然出会ったことが、今回のLAG-3分子がPD-1をはじめとした他の免疫制御分子と協調してリンパ球の自己に対する反応を抑制しているという機能の発見につながりました。
自己免疫疾患は複数の因子が発症に関与する多因子疾患ですが、本来は健常なBALB/cという系統のマウスでもPD-1とLAG-3の両者を欠損させるだけで自己免疫疾患を自然発症したことから、両者の機能をさらに解析することにより自己免疫疾患制御ネットワークシステムの根幹が解明される可能性があります。
人間にもLAG-3がありますが、自己免疫疾患における機能はほとんど解析されていません。今後、人間の自己免疫疾患におけるLAG-3の機能をより詳細に解析すること、LAG-3の機能を制御できる薬剤を開発することにより、自己免疫疾患の新規診断・治療につながる可能性があります。また、自己免疫疾患と同様に異常な免疫応答であるアレルギー疾患、一種の自己免疫応答である腫瘍免疫や移植片の拒絶、自己の細胞に感染して毒性を発揮するウイルス感染症などに対しても、効果的な治療法の開発につながるものと期待されます。
<用語解説>
- 注1) 自己免疫疾患
- 異物を認識し排除するための役割を持つ免疫系が、自分自身の正常な細胞や組織に対してまで過剰に反応し攻撃を加えてしまうことで症状を引き起こす疾患の総称。
- 注2) 親和性成熟とクラススイッチ
- 抗体分子には親和性成熟とクラススイッチという機能修飾が起こる。親和性成熟とは、抗体分子の抗原に対する親和性が抗原刺激により増すことで、クラススイッチとは抗体分子の重鎖定常領域が置換されることにより、抗原特異性を保持したまま、その機能が変化することを言う。
- 注3) NODマウス(non-obese diabetic mouse)
- 加齢により一部のマウスが1型糖尿病を自然発症するモデルマウス。
- 注4) AID(Activation-induced cytidine deaminase)
- 活性化したBリンパ球に発現する、シチジンのアミノ基を取り除きウリジンに変換する酵素。抗体分子の親和性成熟とクラススイッチに必須の酵素であり、AID欠損マウスでは、両者とも全く起こらない。AID欠損マウスは自己免疫疾患を基本的には発症しないが、抗体の機能が不十分なために腸内の細菌が異常増殖しており、それを抑え込むために免疫系が異常に活性化していることが知られている。
- 注5) 1型糖尿病
- 膵臓のインスリン分泌細胞が死滅するために発症する糖尿病。いくつかの原因が報告されているが、自己免疫によるものが最も多いと考えられている。生活習慣の影響が強いとされる2型糖尿病と比較して若年に多い。
- 注6) aidaマウス
- ヴェルディの悲劇のオペラAida(アイーダ)と、aidaマウスが重篤な自己免疫疾患になることを掛けて名付けた。
- 注7) 戻し交配
- 異なる系統のマウスを交配して得られた産仔を、再度片方の系統のマウスと交配すること。特定の遺伝子変異を有するマウスの遺伝子背景を変更する際には、通常10世代以上に渡って戻し交配される。今回は、CBA系統とC57BL/6系統のF1系統で作製されたAID欠損マウスの遺伝子背景をBALB/c系統に変更するために、BALB/c系統に10世代に渡り戻し交配された。
<原論文情報>
Okazaki T. et. al. “PD-1 and LAG-3 inhibitory co-receptors act synergistically to prevent autoimmunity in mice” J Exp Med. 208(2):395 (2011)
(PD-1とLAG-3は協調して自己免疫疾患の発症を制御する)
【渋谷チーム】「敗血症の発症に関与する免疫細胞膜たんぱく質を発見」JEM 2012
<ポイント>
- 敗血症は日本で年間38万人が発症し、死亡率が高い
- 免疫細胞の1つ、肥満細胞の敗血症を抑制する働きをたんぱく質「MAIR-Ⅰ」がコントロール
- MAIR-Ⅰの働きを抑えたマウスでは敗血症の生存率が40%に増加。革新的な治療薬へ期待
免疫受容体注1)の働きは、免疫細胞の細胞膜に存在し、外界からの刺激や情報をキャッチして細胞内に伝えることです。病原体や異物が体内に侵入すると、多種多様な免疫細胞が互いに連携してこれらを排除しますが、そのためには特定の刺激や情報をそれに対応した免疫受容体がキャッチして免疫反応を起こすことが必要です。本研究グループは、免疫受容体の研究を通して、免疫反応を解明し、免疫疾患の克服を目指してきました。
その成果の1つとして本研究グループは、肥満細胞注2)などの細胞膜上に発現する新しい免疫受容体を2003年に世界に先駆けて発見し、これをMAIR-Ⅰ(別名CD300a)と名付けました(参考文献1)。しかし、この免疫受容体の生体内での働きについては、世界中の多くの研究グループによる精力的な研究にも関わらず、不明なままでした。本研究グループは、MAIR-Ⅰがどのような情報をキャッチするかを明らかにするため、アポトーシス注3)(長田チームへリンク)で死んだ細胞の細胞膜上に発現するリン脂質、フォスファチジルセリン(PS)と結合することを突き止め、2011年に世界に先駆けて報告しました(参考文献2)。その結果、MAIR-Ⅰはアポトーシスによって生じた死細胞の出現を感知し、免疫反応をコントロールする免疫受容体であることが判明しました(図1)。
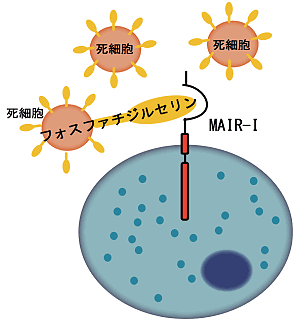
図1 MAIR-Ⅰは死細胞上のフォスファチジルセリンと結合する。
一方、敗血症とは、細菌などの病原体感染が全身に広がり、細菌由来のエンドトキシン(LPS)などの毒素が原因となって全身性の炎症反応が生じることで多臓器不全、血圧低下、ショックなどの症状が引き起こされる状態です。通常、感染症に対しては、抗生物質などによる治療を行いますが、敗血症に至ると有効な手立てがなく、高い確率で死に至ります。日本における同疾患の発症は年に38万人以上と推計され、米国では毎年およそ100万人の患者が発症し、その20-30%が死亡しています。集中治療が必要な患者の死因としては最多の疾患で、新たな治療法の確立が待たれています。
これまで、肥満細胞が化学物質を放出して敗血症発症の抑制に重要な働きをすることは分かっていましたが(参考文献3)、その仕組みが破綻して敗血症が発症してしまう理由はよく分かっていませんでした。
本研究グループは、MAIR-Ⅰが生体内でどのような働きをするかを解明するために、MAIR-Ⅰを産生できない遺伝子欠損マウス(欠損マウス)を作りました。MAIR-Ⅰは死細胞を感知すること、MAIR-Ⅰが発現する肥満細胞は敗血症発症に重要な働きをすること(参考文献3)に着目し、MAIR-Ⅰと敗血症発症との関連を調べました。腹膜炎は腹腔と腹部の臓器を覆っている腹膜に何らかの原因で細菌が感染し、死細胞が多数出現して炎症を起こす疾患で、進行すると敗血症になります。野生型マウスと欠損マウスで腹膜炎による敗血症を誘導し(腹膜炎-敗血症モデル注4))、両者の生存期間を比較しました。その結果、MAIR-Ⅰを産生する野生型マウスでは、腹膜炎発症80時間後の生存率が約10%、100時間後には全て死亡したのに対し、MAIR-Ⅰを産生しない欠損マウスでは腹膜炎発症80時間後の生存率は約60%、100時間後は約40%で、生き残ったマウスはその後回復して死亡することはありませんでした(図2)。この際、欠損マウスの感染場所である腹腔内では、野生型マウスの腹腔内より細菌を直接死滅させる顆粒球注5)が増加しており、実際に細菌の数が減少していました(図3)。
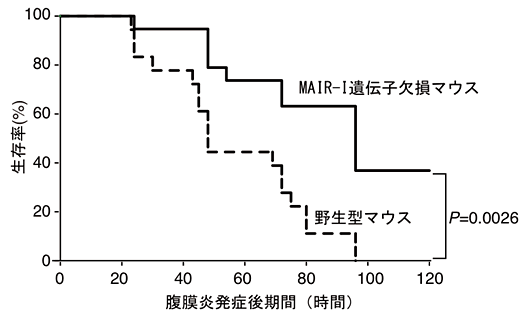
図2 MAIR-Ⅰ遺伝子欠損マウスでは敗血症による生存率が改善する。
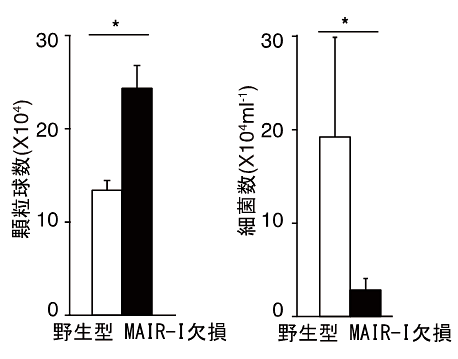
図3 MAIR-Ⅰ遺伝子欠損マウスでは感染局所での顆粒球の数が増加し、細菌の数が減少する。
欠損マウスで敗血症発症後の生存率が高かったメカニズムを明らかにするために、野生型マウスと欠損マウスから肥満細胞を取り出し、敗血症を引き起こす原因となる毒素LPS、およびMAIR-Ⅰと結合するPSを細胞表面に持つ死細胞と一緒に培養しました。その結果、欠損マウス由来の肥満細胞は野生型マウス由来の肥満細胞より、顆粒球を動員する働きのあるケモカイン(たんぱく質)を多量に産生していました(図4)。さらに、MAIR-Ⅰの働きを抑えるたんぱく質MFG-E8注6)を加えると、欠損マウス由来と野生型マウス由来の肥満細胞からのケモカインやサイトカインの産生量は同等になりました(図5)。このことから、肥満細胞に存在するMAIR-Ⅰは死細胞のPSと結合し、顆粒球を動員する働きのあるケモカインの産生を抑制していることが分かりました。
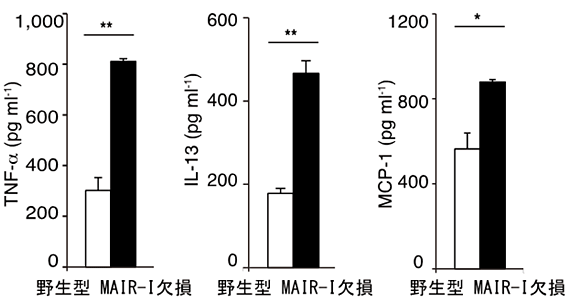
図4 MAIR-Ⅰ遺伝子欠損マウス由来の肥満細胞からは多量のケモカインやサイトカインが産生されている。
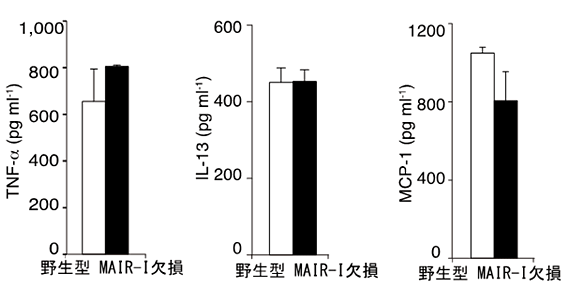
図5 MAIR-Ⅰとフォスファチジルセリンの結合をブロックすると野生型マウスでもケモカインやサイトカインの産生が増加する。
そこで、本研究グループは肥満細胞のMAIR-Ⅰと死細胞のPSの結合をブロックできれば、敗血症を抑えることが可能ではないかと考えました。そのために、野生型マウスで、腹膜炎を起こす直前と、腹膜炎発症18時間後にMAIR-Ⅰに対する中和抗体注7)を腹腔内に投与しました。比較実験として投与した対照抗体においても生存率が若干向上したものの、中和抗体を投与したマウスでは対照抗体を投与したマウスに比べて約35%から約80%へと増加しました(図6)。同様にMAIR-Ⅰと死細胞のPSへの結合をブロックするMFG-E8を投与すると、腹膜炎発症80時間後の生存率が約10%から約40%へと約4倍に上昇しました(図7)。
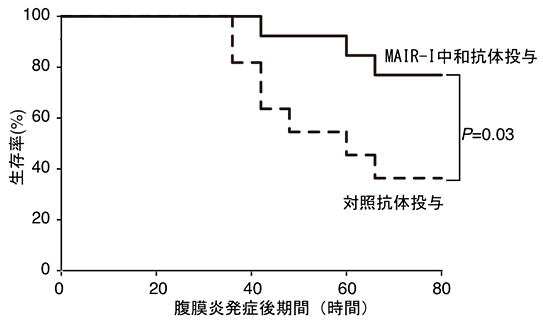
図6 MAIR-ⅠMAIR-Ⅰ中和抗体の投与により敗血症による生存率が改善する。
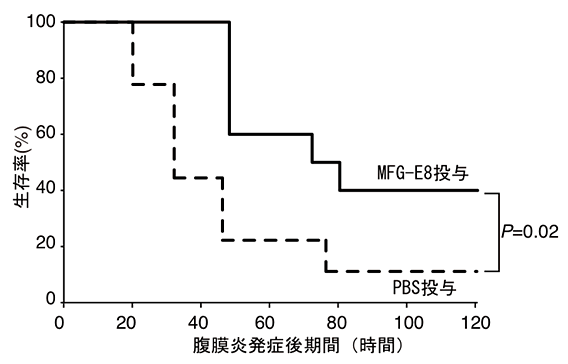
図7 MAIR-Ⅰとフォスファチジルセリンの結合をブロックすると敗血症による生存率が改善する。
敗血症は手術に伴って起こるなど、その発症が予見される場合も多いことから予防法の確立は重要です。本研究成果により、世界中で毎年100万人以上が死亡する敗血症の予防や治療にはMAIR-Ⅰの働きを抑える中和抗体またはMFG-E8が有効な治療薬として期待されます。
また、肥満細胞は抗原抗体反応の結果としてヒスタミンなどの化学物質を放出することで、アレルギー反応を引き起こす原因にもなります。アレルギー反応が起こっている部位では、多くの細胞がアポトーシス死を起こしており、MAIR-Ⅰは過剰なアレルギー反応を抑える上で重要な役割をしている可能性も示唆されます。その点で、MAIR-Ⅰはアレルギーの治療や予防のターゲットにもなることが期待されます。
<特記事項>
本研究は、京都大学 長田 重一 教授、大阪大学 菊谷 仁 教授らの協力を得て行われました。
<原論文情報>
1.Yotsumoto, K., Y. Okoshi, K. Shibuya, S. Yamazaki, S. Tahara-Hanaoka, S. Honda, M. Osawa, A. Kuroiwa, Y. Matsuda, D.G. Tenen, A. Iwama, H. Nakauchi, and A. Shibuya. 2003. “Paired activating and inhibitory immunoglobulin-like receptors, MAIR-I and MAIR-II, regulate mast cell and macrophage activation.” J Exp Med 198:223-233.
2.Nakahashi-Oda, C., S. Tahara-Hanaoka, S.I. Honda, K. Shibuya, and A. Shibuya. 2011. “Identification of phosphatidylserine as a ligand for the CD300a immunoreceptor.” Biochem Biophys Res Commun
3.Echtenacher, B., D.N. Mannel, and L. Hultner. 1996. “Critical protective role of mast cells in a model of acute septic peritonitis.” Nature 381:75-77.
<用語解説>
- 注1) 免疫受容体
- 免疫細胞の細胞膜、細胞質または核内にあるたんぱく質で、特異的な物質(リガンド)と結合して免疫反応を開始させる。
- 注2) 肥満細胞
- 免疫細胞の一種でマスト細胞ともいう。全身の粘膜下や結合組織中に存在し、ヒスタミンなどの化学物質を放出することで炎症やアレルギー応答に重要な役割を持つ。
- 注3) アポトーシス
- 細胞の死に方の1つの形態。プログラムされた細胞死ともいわれ、個体にとって余分な細胞や、危険な細胞が個体の持つ制御機構に従って自殺する時の細胞の死に方。生理的にも毎日、全身の多数の細胞がアポトーシスにより死んで新しい細胞によって置き換わっている。細菌などの感染による炎症反応によってもアポトーシスによる細胞死が起こる。 これに対し、栄養不足などにより細胞質が変化することによって、細胞が死に至る場合はネクローシス(壊死)という。
- 注4) 腹膜炎-敗血症モデル
- 虫垂(盲腸)炎から続発する腹膜炎、敗血症マウスモデル。マウスの盲腸を結紮(けっさつ)し、その先端に針で穴をあける。その結果、腹腔へ便が持続的に漏れ、便中の主に大腸菌により腹膜炎をきたし、その炎症が全身に及んで敗血症に至る。
- 注5) 顆粒球
- 白血球の60%を占め、貪食作用や殺菌能力を持ち、細菌からの防御の役割を果たす。好中球、好酸球、好塩基球の3種類がある。
- 注6) MFG-E8
- Milk Fat Globular Protein EGF-8の略。マクロファージが分泌する463個のアミノ酸からなるたんぱく質。アポトーシス細胞の細胞膜に出現するリン脂質であるフォスファチジルセリンに結合し、MAIR-Ⅰとフォスファチジルセリンとの結合を阻止することによってMAIR-Ⅰの働きを抑えることができる。
- 注7) 中和抗体
- 特定の抗原または、抗原の受容体に結合して、抗体抗原反応を起こさせなくする抗体のこと。
<論文タイトル>
Nakahashi-Oda C. et. al.“Apoptotic cells suppress mast cell inflammatory responses via the CD300a immunoreceptor.” J Exp Med. 209(8):1493 (2012)
(アポトーシス細胞は、CD300a免疫受容体を介して肥満細胞の炎症反応を抑制する)

