2.抗体産生のしくみ
獲得免疫系にはB細胞が産生する抗体(免疫グロブリン)が主体となった液性免疫とT細胞が主体となる細胞性免疫があります。
B細胞が異物である抗原に特異的な抗体を産生するようになるためには、通常はT細胞の助けが必要です。このT細胞はヘルパーT細胞と呼ばれます。先ず、外から侵入してきた異物(病原体等の蛋白分子)は抗原提示細胞である樹状細胞に取り込まれ、ペプチドに分解されます。分解されたペプチドは、主要組織適合抗原(通常はMHCクラスII)と複合体を形成して、抗原提示細胞表面に運ばれます。T細胞表面に発現する抗原受容体(TCR)によって、抗原提示細胞上の抗原ペプチドとMHCクラスIIの複合体が認識されると、T細胞はB細胞に抗体産生を促す刺激を与えるサイトカインを産生するようになります。このT細胞がヘルパーT細胞です。
抗体は可溶性の糖たんぱく質で、血液を始めとする体液中に存在し、病原体等の抗原を認識して結合し、その除去を助ける役割を持つと同時に、B細胞の抗原受容体(BCR)としての役割も持ちます。抗体にはIgG、IgA、IgM、IgD、IgEの5つのクラスがあることがわかっています。
黒崎チームは抗体産生B細胞が、1度目の感染で認識した抗原を如何にして記憶し、二度目以降の感染で迅速に抗体産生能を獲得するのか、そのしくみを明らかにしました。
【黒崎チーム】「メモリーB細胞が抗体産生細胞に分化しやすくなる仕組みを解明」Immunity 2013
私たちの体は、1度出会った細菌やウイルスなどの抗原に再び出会うと、1度目よりも大量の抗体注1)を迅速に作り出して速やかにその抗原を除去し生体を防御します。これは、抗原に初めて出会うIgM型注2)B細胞抗原受容体(BCR)注3)を持つB細胞(IgM型ナイーブB細胞)よりも1度目の免疫反応で抗原を記憶したIgG型注2)BCRを持つB細胞(IgG型メモリーB細胞注4))が素早く反応するためです(図1、図2)。
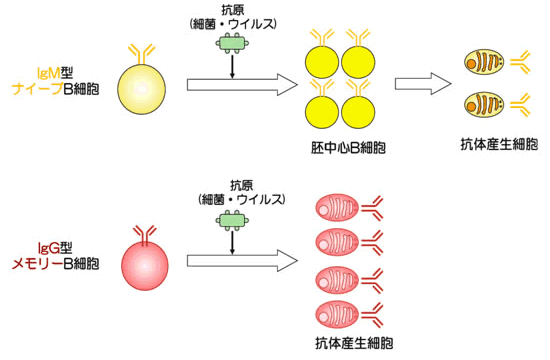
図1 抗原に出会った時のそれぞれのB細胞の抗体産生細胞への分化
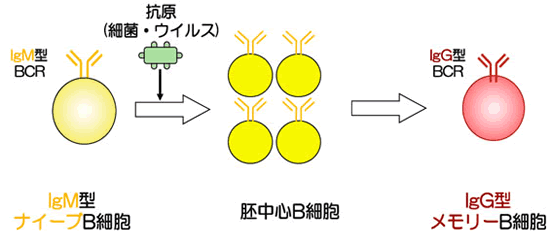
図2 IgM型ナイーブB細胞からIgG型メモリーB細胞への分化
もし、IgG型メモリーB細胞が抗体産生細胞に分化できなくなると、感染防御に対する能力が低下したり、逆に過剰に活性化すると、アレルギーや自己免疫疾患を引き起こしたりしてしまいます。そのため、IgG型メモリーB細胞が抗体産生細胞に素早く分化する仕組みを解明することは非常に重要ですが、その仕組みについては不明のままでした。
これまで、その仕組みを説明する仮説として、大きく2つありました。1つは、IgG型BCRがIgM型BCRよりも細胞内にシグナルを伝達する能力が高いことから、「B細胞の活性化・分化のしやすさは、細胞表面に発現しているBCRの型に起因する」(仮説1)というものです(図3)。一方、「IgM型ナイーブB細胞とIgG型メモリーB細胞は細胞内に発現している分子群にも違いがあり、このことが活性化・分化の能力の違いを引き起こしている」という仮説2も唱えられていました(図3)。これらのどちらが正しいのかは、長く議論されていましたが、今まで決着はついていませんでした。そこで黒崎チームは、マウスを用いた研究により、仮説の検証に取り組みました。
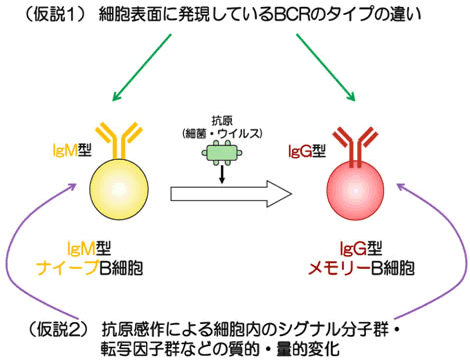
図3 2つの仮説
仮説1を検証するために、IgG型ナイーブB細胞とIgM型ナイーブB細胞を比較する必要がありますが、通常のマウスは、IgG型ナイーブB細胞を持ちません。そこで共同研究グループは、先天的にIgG型ナイーブB細胞を持つクローンマウスを作製しました。そして、IgG型ナイーブB細胞とIgM型ナイーブB細胞に抗原を投与し、抗体産生細胞への分化能力を評価したところ、同程度であることがわかりました(図4)。このことから、BCRの型の違いだけでは、抗体産生細胞への高い分化能力を説明できない、と分かりました。
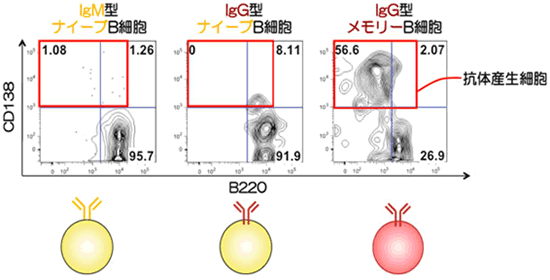
図4 BCRの型の違いによるナイーブB細胞の抗体産生細胞への分化能力の比較
次に、仮説2を検証するためにIgG型メモリーB細胞とIgM型ナイーブB細胞の主立った遺伝子の発現量を比較しました。その結果、IgG型メモリーB細胞では、IgM型ナイーブB細胞に比べて転写因子「Bach2」をコードするBach2 遺伝子の発現量が5分の1に低下していることが分かりました。そこで、分子生物学的手法によりIgM型ナイーブB細胞のBach2の発現量を人為的に減らしたところ、減らす前より約1.8倍、抗体産生細胞に分化しやすくなりました(図5)。これらの結果から、IgG型B細胞から抗体産生細胞への分化を抑制する機能を持つ転写因子Bach2の発現量が、メモリーB細胞では低下するため、抗体産生細胞への分化能力が高くなると分かりました(図6)。転写因子Bach2は抗体産生細胞の分化に必要なBlimp1分子の発現を抑える働きをしています。IgG型メモリーB細胞は二度目以降の抗原(細菌・ウイルス)の感染により、Blimp1の発現が増加しやすいため抗体産生細胞へ迅速に大量に分化できることがわかりました。
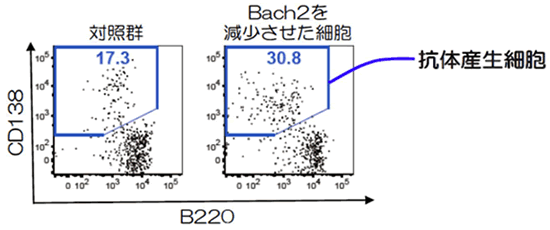
図5 転写因子Bach2の減少による抗体産生細胞への分化能力の変化
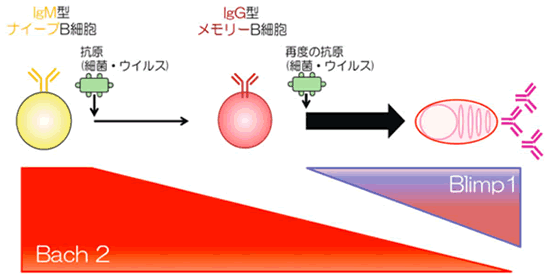
図6 それぞれのB細胞の抗体産生細胞への分化イメージ
今回、IgG型メモリーB細胞では、転写因子Bach2の発現量が厳密に制御されていることが、同じ抗原に再び出会ったときの迅速な応答に必要であることを明らかにしました。つまり、IgG型メモリーB細胞におけるBach2の発現量が正しく制御されないと、抗原に対する防御機能が低下したり、アレルギー反応や自己免疫疾患を引き起こしたりしてしまう可能性を示唆しています。
IgG型メモリーB細胞の働きを理解することは、近年、猛威を振るっているインフルエンザなどに対する効果的なワクチンを開発するうえでも重要です。今後、転写因子Bach2は、ワクチンや免疫疾患の創薬開発において新しい標的となると期待できます。
<用語解説>
- 注1) 抗体
- B細胞が分泌するタンパク質で、抗原に結合し生体防御に働く。抗体が結合した抗原は破壊されたり、体から排除される。
- 注2) IgM型、IgG型
- ある1つの抗原を認識する抗体がさまざまな機能を発揮するために、抗体は一部分を異なる形に変更したものを作り出すことができる。元々の型をIgM型といい、そこからIgG型、IgA型、IgE型という異なる型の抗体を作り出す。
- 注3) B細胞抗原受容体(BCR)
- B細胞が細胞表面に発現するタンパク質で、抗原に結合するとB細胞の活性化を引き起こす。1つのB細胞は一種類の抗原しか認識できないため、生体は細菌やウイルスなどのさまざまな種類の抗原に対応するために多数のB細胞を用意している。
- 注4) メモリーB細胞
- B細胞は、免疫細胞の一種で、細胞表面にあるB細胞抗原受容体(BCR)と呼ばれる部分で病原体などの抗原を認識し、抗体を産生する。B細胞は、抗原の刺激により胚中心B細胞、抗体産生細胞およびメモリーB細胞に分化する。メモリーB細胞は、記憶していた抗原の再刺激を受けると極めて短い期間で抗体産生細胞へと分化して、多量の抗体を作る。
- 注5) 転写因子
- 遺伝子の働きをオンにしたりオフにしたりする機能を持つタンパク質。DNA上に存在する転写を制御する領域に結合し、遺伝子発現のタイミングや量を調節する。
<原論文情報>
Kohei Kometani, Rinako Nakagawa, Ryo Shinnakasu, Tomohiro Kaji, Andrei Rybouchkin, Saya Moriyama, Koji Furukawa, Haruhiko Koseki, Toshitada Takemori and Tomohiro Kurosaki.
“Repression of Bach2, contributes to predisposition of IgG1 memory B cells toward plasma cell differentiation.”
Immunity ,2013,doi:10.1016/j.immuni.2013.06.011

