
総括責任者 高井 義美
(大阪大学 大学院医学系研究科 教授)
研究期間:1994年10月~1999年9月
多細胞生物の個々の細胞は、外界からの刺激を受け、それぞれの局面において果たすべき役割を正しいタイミングで遂行しています。私たちはこのタイミングを決定する機構を『時系制御(バイオタイマー)』と呼び、その解明を試みました。
まず、低分子量G蛋白質が中核的なバイオタイマーであると考え、この分子の機能と作用機構を解析し、その結果、その新しい活性制御因子を見出すと共に、細胞の接着、運動、分泌、遺伝子発現等の低分子量G蛋白質による時系制御機構を解明しました。一方、全く新しい細胞間接着機構を発見し、この機構がcadherin系との関係の基に細胞間接着形成を時・空間的に制御していることを示しました。また、神経シナプスに局在する多数の新しい分子を見出し、これが神経シナプス接着分子や神経伝達物質受容体をシナプスに効率よく集積させ、記憶学習の時系制御に関与していることを明らかにしました。
これらの成果から、複雑な細胞機能の制御機構とその異常に基づく種々の疾病の病態が分子レベルで理解されることが期待されます。
成果
1.神経伝達物質放出の時系制御因子の発見と機能の解明
私たちが見出したRab3サブファミリー低分子量G蛋白質とその活性化阻害因子(RabGDI)は神経伝達物質放出の時系制御に関与している。今回、Rab3サブファミリーを活性化する因子(Rab3 GEP)を見出し、Rab3 GEPがRab GDIと共に神経伝達物質の放出と、それに引き続く記憶形成に関与していることを解明した。
2.個体発生における低分子量G蛋白質の機能の解明
細胞骨格の制御に関わるRhoファミリー低分子量G蛋白質の活性化阻害因子(Rho GDI)、細胞増殖・分化の制御に関わるKi-Ras/Rap1/Rhoファミリー低分子量G蛋白質の活性制御因子(Smg GDS)の欠損マウスをそれぞれ作製し、これらの低分子量G蛋白質が個体発生の時系制御に果たす役割を解明した。
3.細胞運動と神経軸索伸長の時系制御因子の発見と機能の解明
細胞運動や神経細胞軸索伸長において重要なアクチン細胞骨格のリモデリングを制御する新規分子(frabin)を見出した。Frabinは既存のアクチン細胞骨格に依存してCdc42低分子量G蛋白質を活性化し、新しい構造のアクチン細胞骨格(filopodia)の形成を時・空間的に制御していることを解明した。
4.細胞間結合と細胞基質間結合の新しいF-アクチン結合蛋白質の発見
細胞間結合と細胞基質間結合の新しいF-アクチン結合蛋白質(neurabin、nexilin)を見出した。Neurabinは、frabinと異なるアクチン細胞骨格(lamellipodia)の形成を制御して神経軸索の伸長に、nexilinは細胞基質間結合とアクチン細胞骨格との連結にそれぞれ関与していることを解明した。
5.新しい細胞間接着機構の発見と機能の解明
上皮細胞間結合の新しい接着機構を見出し、NAP系と命名した。NAP系は、接着分子(nectin)とこれをアクチン細胞骨格に連結する分子(afadin)、およびcadherin系に連結する分子(ponsin)の、少なくとも3つの構成因子から成り、接着帯と密着帯の形成を時・空間的に制御していることを解明した。
6.神経シナプスの新しい構成因子の発見
神経シナプスの多数の新しい構成因子(SAPAP、S-SCAM、BEGAIN、MAGUIN、SPAL、synamon、nRap GEP、nArgBP2)を見出し、これらが神経シナプス接着因子や神経伝達物質受容体、可塑性に関わるシグナル分子等を神経シナプスに効率よく集積させ、記憶学習の時系制御に関与していることを提唱した。
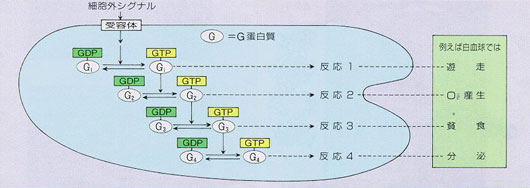
▲バイオタイマーの概念
各々のG蛋白質は、その制御する反応の持続時間を決定するとともに、1つの細胞外シグナルに対して、反応1、2、3、4がこの順番に発現するように時間的秩序を制御している。
研究成果
評価・追跡調査