
研究総括 高柳 広
(東京大学 大学院医学系研究科 教授)
研究期間:2009年~2014年
骨はこれまで、単に生体を支持し運動を可能にする硬い組織としての認識に留まってきました。しかし近年の研究から、骨は単なる運動器の一部ではなく、外界の環境変動やストレスを感受し、免疫系など他の生体系を能動的に制御していることが明らかになりつつあります。そこで、骨と全身生体系との相互作用を分子レベルで解明し、脊椎動物の生体系を「骨による外界からの刺激感受と骨による全身の生体系制御システム=オステオネットワーク」として捉え直し、このオステオネットワークの解明に取り組みました。その結果我々は、オステオネットワークを制御する骨産生因子(=オステオカイン)を複数同定し、これらを介した生体制御システムを生体レベルで明らかにすることに成功しました。さらに、こうしたオステオネットワークの破綻が、骨粗鬆症などの運動器疾患や感染症などの免疫疾患の病態形成に関わることを実証しました。本プロジェクトの成果から、生命システムの理解を深めるのみならず、骨と他臓器に共存する種々の疾患の解明や、それらに対する新薬開発の基盤に繋がることが期待されます。
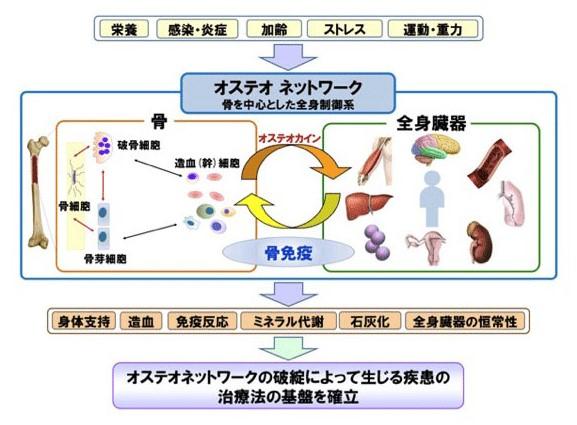
研究成果の概要
本プロジェクトは、オステオネットワーク解析グループ、オステオイムノロジーグループ、オステオサイト・マウスジェネティクスグループの3つのグループにより構成され、互いに連携しながら、本プロジェクトの主眼である「骨を中心とした全身制御ネットワーク」の解明に向け融合的な研究を推進した。具体的には、骨が産生して全身を制御する因子を「オステオカイン」と名付け、その分子レベルでの同定、および遺伝子改変マウスを用いた生体レベルでの生理的意義の解明を進めた。さらに、オステオカインを介した骨と他臓器との相互作用、骨と骨髄環境の相互作用を多角的に検索し、オステオネットワークの破綻と様々な全身性疾患の発症メカニズムとの関連性を明らかにした。本プロジェクトでは、オステオカインに限らず、骨構成細胞や免疫細胞の分化・機能に関わる多数の制御因子の同定にも成功しており、骨と連関する疾患の新規治療戦略の分子基盤確立に繋げることに成功した。
研究成果
(1)オステオネットワーク解析グループ(オステオカインの同定、オステオネットワークを標的とするドラッグディスカバリー):
骨構成細胞のトランスクリプトームやプロテオーム等の網羅的発現解析、ならびに機能的スクリーニング解析を駆使し、骨構成細胞が産生するオステオカインの同定に取組み、遺伝子改変マウスの作製・解析を通じてオステオカインの生理的意義の解明を目指した。
破骨細胞が、神経軸索誘導因子の一つであるSema4Dを大量に産生することを見出し、骨芽細胞に作用して骨形成を強力に抑制するオステオカインであることを明らかにした 1。Sema4Dに対する阻害抗体を投与することで、骨粗鬆症マウスにおける骨量低下を効果的に予防・治療することに成功した。また神経・免疫制御因子であるSema3Aが骨芽細胞から産生され、骨芽細胞自身と破骨細胞の両者に働きかけて、骨形成の促進と骨吸収の抑制という2つの作用をもたらすオステオカインであることを見出した 2。Sema3Aのリコンビナントタンパク質を投与することで、マウスの骨減少性疾患モデルに対して治療効果を確認できた。さらに、骨量が低下傾向にある加齢マウスでは、血中のSema3A量が低下していることも確認でき、Sema3Aが疾患診断バイオマーカーとして有効であることが示唆された。また、骨芽細胞が分泌する骨髄造血制御因子IL-7が共通リンパ球前駆細胞の分化を支持するオステオカインであることを明らかにした (オステオイムノロジーグループとの連携による成果) 3。マウスの敗血症モデルを用いて、急性炎症時におこるリンパ球減少症が、骨髄の骨芽細胞数の劇的な低下に伴うIL-7の産生障害に起因することを見出した。
その他、加齢に伴う骨量減少に関わる因子の同定や 4、破骨細胞分化に必要なチロシンキナーゼBtkに対する新規阻害剤ibrutinibの骨粗鬆症薬としての有効性の証明 5など、多数の創薬ターゲット候補因子を見出した。今後、こうした研究シーズを更に展開させ、臨床応用に実用可能な新規薬剤の開発、生体レベルでの有効性について検証を重ねることで、運動器・免疫疾患に対する新しい治療アプローチの開発に繋がることが期待される。
- T. Negishi-Koga, M. Shinohara, N. Komatsu, H. Bito, T. Kodama, R. H. Friedel and H. Takayanagi. Suppression of bone formation by osteoclastic expression of semaphorin 4D. Nat. Med., 17(11), 1473-1480, 2011
- M. Hayashi, T. Nakashima, M. Taniguchi, T. Kodama, A. Kumanogoh and H. Takayanagi. Osteoprotection by semaphorin 3A. Nature, 485(7396), 69-74, 2012
- A. Terashima, K. Okamoto, T. Nakashima, S. Akira, K. Ikuta, H. Takayanagi. Immunosuppression caused by sepsis-induced osteoblast ablation., Immunity, in press, 2016
- K. Nishikawa, T. Nakashima, S. Takeda, M. Isogai, M. Hamada, A. Kimura, T. Kodama, A. Yamaguchi, M. J. Owen, S. Takahashi, and H. Takayanagi. Maf Promotes Osteoblast Differentiation in Mice by Mediating the Age-Related Switch in Mesenchymal Cell Differentiation. J. Clin. Invest., 120(10), 3455-3465, 2010
- Shinohara, B. Y. Chang, J. J. Buggy, Y. Nagai, T. Kodama, H. Asahara, H. Takayanagi. The orally available Btk inhibitor ibrutinib (PCI-32765) protects against osteoclast-mediated bone loss. Bone, 60, 8-15, 2014
(2)オステオイムノロジーグループ(骨髄造血を担うオステオカインの同定、炎症性骨破壊機構の解明、骨と免疫系の相互作用解析):
骨免疫学の深化・飛躍を目指し、骨髄造血を担うオステオカインの同定、炎症性骨破壊に関わる免疫細胞と破骨細胞活性化機構の解明、骨と免疫系の相互作用の解明に取組んだ。
各骨構成細胞を特異的に欠損させた遺伝子改変マウスを作製し、骨構成細胞が産生する造血制御オステオカインの同定に取組んだ。その結果、骨芽細胞が産生する骨髄造血制御因子IL-7が共通リンパ球前駆細胞の分化を支持するオステオカインであることを明らかにした (オステオネットワークグループとの連携による成果・上記参照)。
関節リウマチにおける炎症性骨破壊は、Th17細胞と呼ばれるヘルパーT細胞サブセットが活性化することで、滑膜線維芽細胞上での破骨細胞分化必須因子RANKLの発現が増強し、破骨細胞分化が促進されるために異常な骨破壊が生じる。本グループでは、転写制御因子IκBζがTh17細胞分化に関わる転写プログラムを制御していることや 1、自己抗原特異的なFoxp3+T細胞が炎症環境下においてFoxp3の発現を失い、高い破骨細胞分化誘導能を有する特殊なTh17細胞(exFoxp3Th17細胞)へと分化転換することで関節炎の病態形成を促すこと 2、などTh17細胞分化・発生に関わる新機構を見出した。また免疫複合体産生は、関節リウマチに付随する特徴的な免疫学的異常であるが、免疫複合体が破骨細胞に直接作用して骨吸収を誘導することを見出し、新たな免疫による骨制御機構を見出した 3。その他にも、破骨細胞分化を制御する膜タンパク質Ly49Q、破骨細胞分化の転写プログラムに関わる転写因子Blimp1やLRF、破骨細胞の生存に関与するアポトーシス抑制因子Noxaなど、多数の破骨細胞制御因子の同定に成功した。さらに、胸腺上皮細胞で発現し、T細胞の中枢性免疫寛容を制御する転写因子Fezf2を同定し、自己反応性T細胞の発生に関わる新規メカニズムを明らかにした 4。
骨と免疫系の相互作用と共通性の解明については、IL-17産生性γδT細胞が骨再生のイニシエーターとして働き、損傷後の治癒過程に深く関わることを明らかにした 5。骨免疫学はこれまで主に関節リウマチの病態研究により発展してきた経緯があるが、本プロジェクトにより新たな骨と免疫系の相互作用を明らかにすることができた。これらの成果は、関節リウマチだけでなく、他の難治性免疫疾患・運動器疾患に対する新たな医療技術の創出につながる可能性があり、今後制御法の確立を含め研究展開が期待される。
- K. Okamoto,Y. Iwai, M. Oh-hora, M. Yamamoto, T. Morio, K. Aoki, K. Ohya, A. M. Jetten, S. Akira, T. Muta and H. Takayanagi, IκBζ regulates TH17 development by coopereating with ROR nuclear receptors., Nature, 464(7293), 1381-1385, 2010
- N. Komatsu, K. Okamoto, S. Sawa, T. Nakashima, M. Oh-hora, T. Kodama, S. Tanaka, J. A. Bluestone, H. Takayanagi. Pathogenic conversion of Foxp3+ T cells into TH17 cells in autoimmune arthritis., Nat. Med., 20(1), 62-68, 2014
- T. Negishi-Koga, HJ. Gober, E. Sumiya, N. Komatsu, K. Okamoto, S. Sawa, A. Suematsu, T. Suda, K. Sato, T. Takai, H. Takayanagi. Immune complexes regulate bone metabolism through FcRγ signaling., Nat. Commun., 6, 6637, 2015
- H. Takaba, Y. Morishita, Y. Tomofuji, L. Danks, T. Nitta, N. Komatsu, T. Kodama, H. Takayanagi. Fezf2 orchestrates a thymic program of self-antigen expression for immune tolerance., Cell, 163(4), 975-987, 2015
- T. Ono, K. Okamoto, T. Nakashima, T. Nitta, S. Hori, Y. Iwakura, H. Takayanagi. IL-17-producing γδT cells enhance bone regeneration., Nat. Commun., 7, 10928, 2016
(3)オステオサイト・マウスジェネティクスグループ(骨細胞の細胞特性・機能の解明、オステオネットワーク解明のための新規遺伝子改変マウスの作出):
メカニカルストレスやホルモンなど生理活性分子の感受・応答ついては、骨細胞(オステオサイト)がその責任細胞であるという可能性が示唆されているが、骨細胞の細胞特性やその機能はほとんど不明であった。我々は、骨細胞をターゲットとした新規アッセイ系の構築やモデルマウスの開発などから、骨細胞の未だ明らかにされていない細胞特性や機能を理解し、環境・全身生体系による骨リモデリング制御機構の解明に取組んだ。また、他チームとの横軸研究で連携をとりながら、オステオカインならびにオステオネットワーク関連分子に関する遺伝子改変マウスの作出・解析を進めた。
骨細胞は骨に埋め込まれた状態で存在するため、その単離培養が非常に困難であり、これまで細胞生物学的な特性が不明であった。我々は骨細胞特異的にGFP蛍光タンパク質を発現する遺伝子改変マウスを作製し、骨細胞を骨組織から高純度に単離することに成功した。さらに、骨細胞が破骨細胞分化促進因子RANKLを強力に発現していることを明らかにした。骨細胞特異的にRANKLを欠損させたマウスを作製したところ、大理石骨病を発症することを見出し、骨細胞が骨リモデリングの開始を司る指令細胞であることを世界に先駆けて証明した 1。骨細胞特異的なRANKL欠損マウスは、生後すぐには大理石骨病を発症せず、成長に伴い病状が現れることから、メカニカルストレスによるRANKL発現の機構も示唆された。本成果は、骨内にネットワークを張り巡らした骨細胞による骨代謝制御の分子実体に迫る重要な発見であり、骨細胞による骨代謝制御や他臓器制御のネットワークの全貌解明につながると考えられる。
一方T細胞特異的にRANKL遺伝子を欠損させたマウスでは、骨表現型に異常がないもの、多発性硬化症のマウスモデルに高い抵抗性を示すことが判明した。T細胞上のRANKLは自己免疫性T細胞の中枢神経組織浸潤に必要であり、多発性硬化症における中枢神経組織内の炎症誘導に関わることが明らかとなった (オステオイムノロジーグループとの連携による成果) 2。RANKLに対する中和抗体が骨粗鬆症やがんの骨転移病変の治療薬に承認され、骨疾患分野で注目されているが、本成果により、RANKLを標的とした新しい疾患制御の可能性を示すことができた。
- T. Nakashima, M. Hayashi, T. Fukunaga, K. Kurata, M. Oh-Hora, JQ. Feng, LF. Bonewald, T. Kodama, A. Wutz, EF. Wagner, JM. Penninger and H. Takayanagi. Evidence for Osteocyte Regulation of Bone Homeostasis through RANKL Expression. Nat. Med., 17(10), 1231-1234, 2011
- MM. Guerrini, K. Okamoto, N. Komatsu, S. Sawa, L. Danks, JM. Penninger, T. Nakashima, H. Takayanagi. RANKL inhibition prevents autoimmune inflammation in the central nervous system., Immunity, 43(6), 1174-1185, 2015