
総括責任者 御子柴 克彦
(東京大学 医科学研究所 教授/理化学研究所 脳科学総合研究センター グループ・ディレクター)
研究期間:1995年10月~2000年9月
細胞内セカンドメッセンジャーとしてのカルシウムの働きは多岐にわたるので、本プロジェクトではできるだけ幅広く受精、卵割、発生から神経細胞の成長、分化、神経系における情報伝達と高次機能など広範囲の研究を行い、その結果、アフリカツメガエル胚の背腹軸の形成に関するイノシトール3燐酸受容体(IP3R)を介した細胞内カルシウムの機能、同受精卵でのIP3誘発カルシウム放出による細胞表層構造の制御、ニワトリ胚での細胞内カルシウム放出による神経成長制御機構の解明、IP3Rとその結合タンパクとの分子間相互作用、IP3R1型欠損マウスにおける小脳の長期抑圧の欠損と海馬CA1、CA3領域の長期増強の増加、リアノジン受容体によるシナプス可塑性と行動・学習の調節など多くの成果を得た。カルシウムの機能全体からみれば、最も基本的な部分を解明したことになるが、このような基礎研究の積み重ねによりいずれは全体像が明らかにされるであろう。その意味で、本プロジェクトにおける研究成果は脳の高次機能をはじめとする生命現象の本質を解き明かすのに大きく貢献するものと考えられ、また得られた成果は種々の疾患や外傷により傷ついた神経の再生、てんかんのような脳機能障害の病因の解明、記憶のメカニズムの解明、卵割から発生に至る分子機構の解明による発生医学の発展など今後の展開が期待できると思われる。
成果
アフリカツメガエル胚の背腹軸形成機構の解析
4細胞期の腹側の割球に抗IP3受容体モノクローナル抗体を注入すると、発生の運命が腹側から背側の構造形成へと変更された。この実験から、IP3受容体を介した細胞内Ca2-シグナルが、正常胚では腹側化に関与する可能性が示された。
IP3誘発Ca放出による細胞制御能の発見
アフリカツメガエル受精卵内へIP3を注入するとCa波が生じ、一過性に表層の収縮が生じた。IP3受容体を介したCa放出が細胞表層の構造を制御する可能性を示した。
細胞内カルシウム放出による神経成長制御機構の解明
発生または再生途上の神経突起先端に在る成長円錐には1型イノシトール3リン酸(IP3)受容体が発現することを見い出し、IP3受容体を介した細胞内カルシウム貯蔵庫からのカルシウム放出が神経突起伸長に重要な要素であることを明らかにした。
イノシトール3リン酸(IP3)受容体の分子間相互作用
IP3受容体と相互作用する新たな分子を表面プラズモン共鳴センサーとYeast Two-Hybrid Systemによる異なるアプローチで各々解析した。IP3受容体とIP3との詳しい結合解離反応様式や新たにカーボニックアンヒドラーゼ関連蛋白質がIP3受容体と結合することが判明した。
IP3-1型受容体欠損マウスの生理学的解析
IP3-1型受容体遺伝子欠損マウスを作成し、その生理学的特徴を調べた。神経シナプス可塑性に関しては、小脳の長期抑圧が欠損し、また海馬CA1、CA3で長期増強が増加していることがわかった。またNMDA受容体の活性の亢進、GABAB受容体の活性が低下していることがわかった。
リアノジン受容体によるシナプス可塑性と行動・学習の調節
遺伝子欠損マウスを用いた解析により、細胞内カルシウム貯蔵庫から細胞質へのカルシウム放出チャネルであるリアノジン受容体が、細胞外からのカルシウム流入とは異なる機構で、海馬シナプス可塑性、および個体の行動・学習を調節していることが示された。
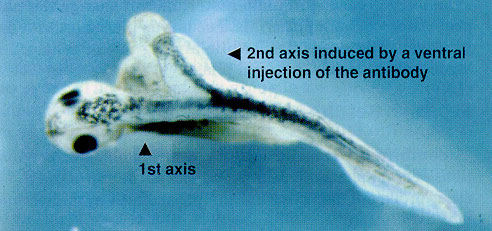
▲IP3R機能阻害抗体の背筋軸に対する影響(最近の主な成果参照)
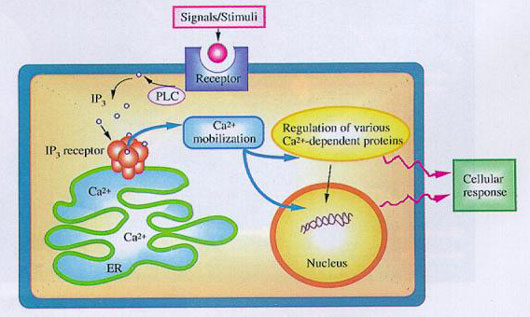
▲Ca2+による細胞内情報伝達の模式図
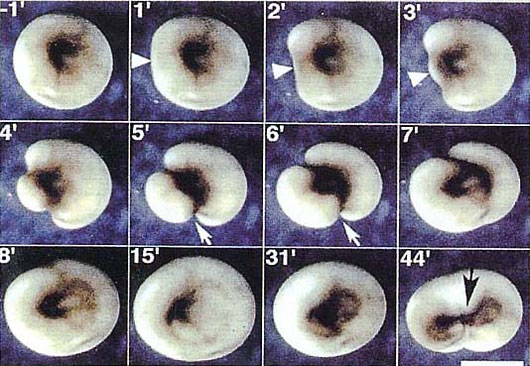
▲図5 IP3(4μ M,15nl)注入後のアフリカツノメガエル受精卵の形態変化
時刻0′(分)で注入。
白い矢頭:注入部位、
白い矢印:収縮部位、
黒い矢印:第一卵割溝、
バー:1000μm
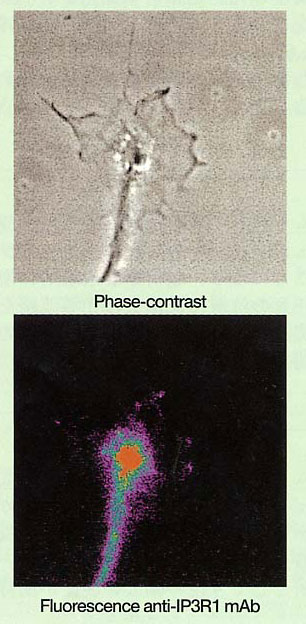
▲Localization of Type 1 IP3 Receptors in Neuronal Growth Cone
研究成果
評価・追跡調査