
総括責任者 加藤 誠志
((財)相模中央化学研究所 主席研究員)
研究期間:1995年10月~2000年9月
細胞を構成している未知の蛋白質ネットワークを解明するために、ある特定の活性を手掛かりに蛋白質を探索するという従来のアプローチではなく、まず機能未知の蛋白質をそろえてから、それらの機能を探索するというアプローチを試みました。すなわち、ヒト完全長cDNAバンクを出発材料にして、新規cDNAがコードしている蛋白質をインビトロ翻訳や細胞内発現によって実際に手にした後、それらの蛋白質の細胞内局在部位の決定や相互作用する蛋白質の探索を通じて新しい蛋白質ネットワークを見つけていくというやり方です。
その結果、細胞周期を制御している新しい蛋白質修飾経路、転写機構に関る新しい核蛋白質複合体、細胞内蛋白質の新規糖鎖修飾など、新しい蛋白質ネットワークを見つけることができました。本プロジェクトによって試行されたアプローチは、ポストゲノムシーケンス時代の分子細胞生物学研究において威力を発揮することが期待されます。
成果
蛋白質の新規修飾系NEDD8経路の発見
ユビキチン様蛋白質NEDD8がカリンファミリーの蛋白質群に共有結合する新規修飾経路を見いだした。さらに、NEDD8化がユビキチンリガーゼの活性調節を介して細胞周期の制御に関与していることを分裂酵母を用いて証明した。
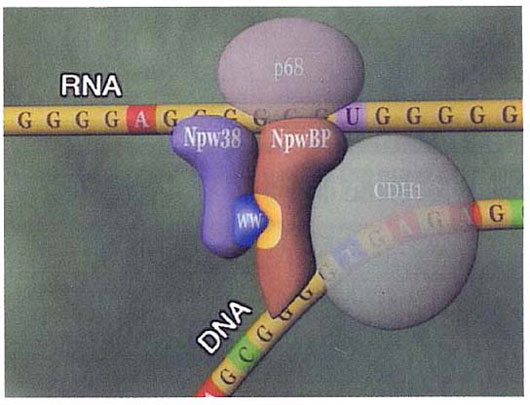
WWドメインを介する新規核蛋白質複合体の発見
機能未知のヒト完全長cDNAの中からWWドメインを含む新規核蛋白質Npw38並びにこれと結合するRNA/DNA結合蛋白質NpwBPを同定し、これらの蛋白質の相互作用がWWドメインと新規モチーフの結合を介して起こることを解明した。
細胞内蛋白の新規糖鎖修飾の発見
細胞質クレアチンキナーゼのSer、Thr残基がO-グルコシレーションを受けていることを見いだした。この結果は、細胞内蛋白質の新しい糖鎖修飾機構の存在ならびにそれによる機能制御の可能性を示唆するものである。
ヒト完全長cDNAクローンの大規模局在解析
ヒト完全長cDNAクローンとウロキナーゼcDNAや緑色蛍光蛋白質cDNAの融合遣伝子発現による局在解析を行い、新規II型膜蛋白質、新規スプライセオソーム構成成分、新規RNAヘリカーゼ、不死化細胞特異的核蛋白質などを含む多くの新規蛋白質の同定に成功した。
cDNA免疫による抗体作製
ヒト完全長cDNA発現ベクターを注射や遺伝子銃でネズミに投与するだけで、cDNAがコードしているヒト蛋白質に対する抗体が作れることを実証した。さらに、抗体産生効率を上げるための手法を開発した。
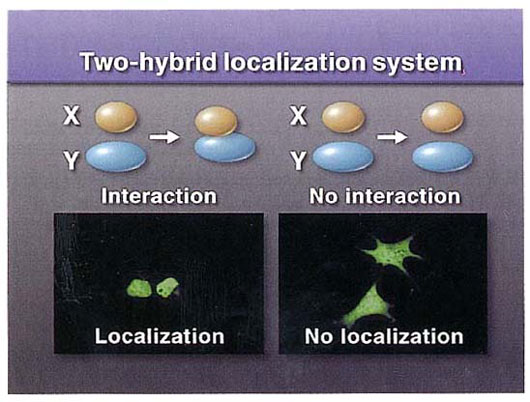
2ハイブリッド局在化法による蛋白質間相互作用の検出
蛋白質―蛋白質相互作用を、細胞内で同時発現させた蛋白質の局在の変化を見ることによって検出する方法を開発した。本法を用いれば、蛋白質間の結合を細胞内の環境下で、迅速にかつ視覚的に判定できる。
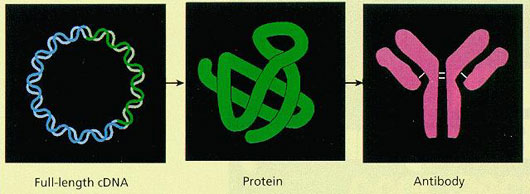
▲蛋白質ネットワーク解明のための道具箱
研究成果
評価・追跡調査