
研究総括 浜地 格
(京都大学 大学院工学研究科 教授)
研究期間:2018年10月~2025年3月
※本プロジェクトは、追加支援期間(ノーコストエクステンション型)の枠組みにより当初研究期間を(1年)延長し、2025年3月までJSTが支援を行うことになりました。
グラント番号:JPMJER1802
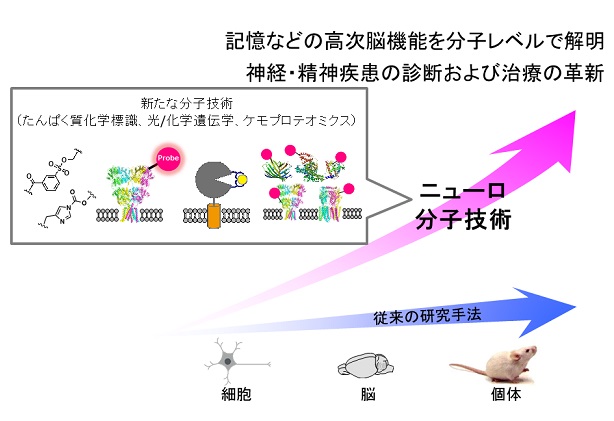
たんぱく質をそれが存在する生細胞環境で狙い通りに修飾できる生細胞有機化学的手法を新しく開発するとともに、標的たんぱく質の機能を自在に制御できる独自の化学的および光化学的手法(化学遺伝学および光化学遺伝学)を開発します。そしてこれらの化学的方法論を、モデル細胞だけでなく、より複雑な培養神経細胞や脳組織、生物個体でも適用できるレベルまで格段に発展させることにより、記憶や神経・精神疾患と直接関連する神経伝達物質受容体やその相互作用たんぱく質の選択的なイメージングや動態解析、あるいは機能制御による神経細胞間相互作用ネットワークの分子レベルでの解析などを実現します。
本プロジェクトを通じて、ニューロ分子技術とも呼ぶべき新たな基盤技術を確立することにより、記憶などの高次脳機能の分子レベルでの理解など神経科学分野への展開だけでなく、神経・精神疾患といったこれからの人類が克服すべき多くの疾病の診断や治療法開発へとつながることが期待されます。
研究グループ
(1)生体有機化学反応開発グル-プ
(2)タンパク質活性制御技術の開発グル-プ
(3)神経細胞・脳組織での活性制御・可視化グル-プ
(4)個体レベルでの制御および生理的意義解明グル-プ
研究成果の概要
自閉スペクトラム症・うつ病・認知症などの精神・神経疾患は、近年増加の一途を辿っており、現代社会の大きな課題である。その一方で、神経・脳科学に関する基礎研究の進歩は著しく、分子レベルの研究成果が脳機能と直接の連関で語られる時代を迎えている。このような背景の下、本プロジェクトでは、神経系や脳内での情報伝達や細胞間ネットワーク形成を個々のタンパク質分子レベルで精密に解明することに資する、独創的な「ケミカルバイオロジー分子技術」の創製を研究目標とした。
実際に、神経伝達物質受容体を主な標的タンパク質として研究を進め、生細胞や生きたマウス脳内で、遺伝子操作なしに、狙い通りに色々な機能分子を修飾できる化学標識戦略を実現した。これは、脳内有機化学とも言うべき新分野の創成につながる成果と期待される。
さらに、受容体及びパートナータンパク質間の相互作用を制御し、神経伝達を操作できる人工シナプスコネクターの創出にも成功した。また、化学標識が困難とされてきた生体膜の主成分である特定脂質のオルガネラ選択的なラベル化・イメージング法を開発した。
研究成果
遺伝子操作なしに狙った受容体に様々な機能性分子を修飾できる化学標識戦略を実現
脳内において、神経伝達物質受容体は記憶や学習に関わる重要なタンパク質である。神経伝達物質受容体を解析することは、記憶・学習や、脳神経疾患のメカニズム解明などにつながる。
これまでに、研究グループでは、遺伝子操作なしに天然タンパク質を標識試薬で化学修飾する独自の手法「リガンド指向性化学」(注1)を開発してきた。本プロジェクトにおいて、リガンド指向性化学の性能向上や適用を広げ、生きている動物の脳で、狙った天然の受容体を標識することに成功した(In brainリガンド指向性化学, 図1)。
本手法は、ラベル化剤を投与した時点で、細胞表層に発現し機能している受容体をパルス標識できる特徴を持っている。これを利用することで、ある時点で標識した受容体がその後どのような運命をたどるのかを追跡できる。実際に、多数のシナプスが新しく形成・分解される生後発達期において、小脳のAMPA受容体(注2)の動態をパルスチェイス解析により明らかにした。本標識法は、霊長類を含む様々な生物種や疾患モデル生物に対して適用可能であり、国内外の研究者との共同研究が進んでいる。
さらにIn brainリガンド指向性化学を基盤に、時空間分解能に優れた光駆動の新規な近傍ラベリング法(注3)としてPhoxID法(図2)を開発し、高い時空間分解能で生きたマウス脳内の受容体インタラクトーム(タンパク質間相互作用ネットワーク)を同定することにも成功した。神経伝達物質受容体のインタラクトームの解明は、記憶・学習といった複雑な脳機能を理解する上で重要であり、脳内で適用可能な手法が期待されていた。
研究グループは、In brainリガンド指向性化学を用いて、生きたマウス脳内の標的受容体に光増感剤を修飾し、その後、光ファイバーを用いて脳内に緑色光を照射し一重項酸素を発生させ、周辺タンパク質を酸化した。この酸化タンパク質を質量分析することで、受容体インタラクトームの同定に成功した。本手法により、生後発達期から成熟期にかけて、シナプス形成に重要な AMPA受容体の周辺タンパク質群が変化することとともに、幼若期特異的に AMPA受容体の周辺に存在する複数のタンパク質を発見した。本技術は、脳機能を分子レベルで仮説フリーに解析するための強力な研究ツールとしての発展が期待できる。

図1. 生きた動物脳内の狙った天然の受容体を標識可能なIn brainリガンド指向性化学
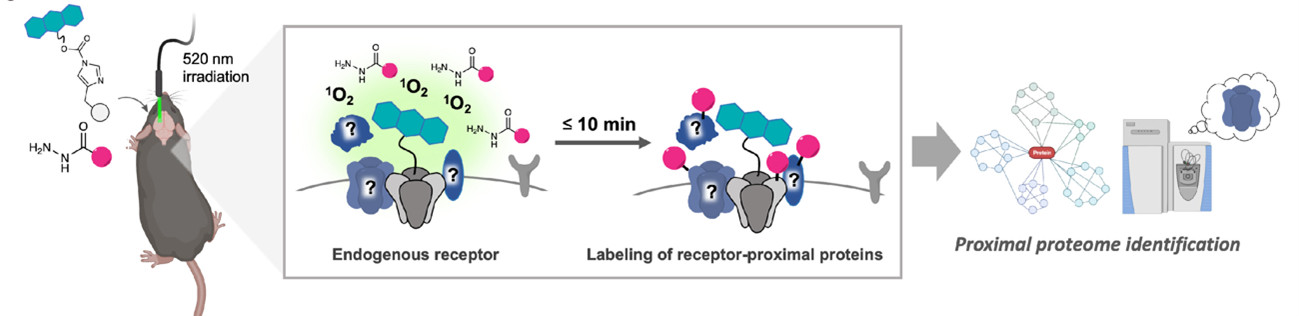
図2. PhoxID法による生きたマウス脳内の受容体インタラクトーム解析
- “Ligand-directed two-step labeling to quantify neuronal glutamate receptor trafficking” K. Ojima, K. Shiraiwa, K. Soga, T. Doura, M. Takato, K. Komatsu, M. Yuzaki, I. Hamachi*, S. Kiyonaka*, Nature Communications, 12, 831(2021).
- “Bioorthogonal chemical labeling of endogenous neurotransmitter receptors in living mouse brains” H. Nonaka, S. Sakamoto, K. Shiraiwa, M. Ishikawa, T. Tamura, K. Okuno, T. Kondo, S. Kiyonaka, E. A. Susaki, C. Shimizu, H. R. Ueda, W. Kakegawa, I. Arai, M. Yuzaki, Itaru Hamachi*, Proceedings of the National Academy of Sciences of USA, 121, e2313887121 (2024).
- “Photoproximity labeling of endogenous receptors in the live mouse brain in minutes” M. Takato, S. Sakamoto, H. Nonaka, F. Y. T. Valor, T. Tamura*, I. Hamachi*, Nature Chemical Biology, 21, 109-119 (2025).
(注1)リガンド指向性化学
研究グループが開発した天然タンパク質を生体環境中で選択的に化学修飾できる手法。標的タンパク質に親和性を有するリガンドと標的タンパク質に導入したい機能性分子を、脱離性反応基でつないだ標識試薬(ラベル化剤)を利用する。
(注2)AMPA受容体
人工アミノ酸であるAMPA(α-アミノ-3-ヒドロキシ-5-メソオキサゾール-4-プロピオン酸)を選択的に受容することから名づけられた、四量体イオンチャネル型グルタミン酸受容体。興奮性シナプス後膜に発現し、記憶・学習において重要な役割を担っている。
(注3)近傍ラベリング
標的となるタンパク質の周辺で短寿命活性種を発生させ、これにより近傍に存在するタンパク質をビオチン標識する手法。
途切れた神経回路を再びつなぐ人工シナプスコネクターの開発
神経細胞と神経細胞のつなぎ目であるシナプス(注4)は、シナプスオーガナイザー(注5)の働きによって発達期から生涯にわたって形成、維持、再構築される。自閉スペクトラム症、統合失調症、アルツハイマー病など多くの精神・神経疾患の発症は、シナプスの数や機能に異常があることが一因と考えられており、シナプス異常を是正する方法の開発が望まれている。
研究グループは、シナプス前部と後部をつなぐ作用を持つ人工シナプスコネクターCPTXを開発した(図3)。CPTXは幅広い神経回路でシナプスを接続できる強力な特性を持ち、CPTXをシナプスの減少や異常を伴う小脳失調、アルツハイマー病、脊髄損傷のモデルマウスに投与すると、数日以内にシナプスが再形成され、協調運動の改善、学習・記憶機能の回復、まひした後ろ足の運動機能の回復など、それぞれの病態について著しい改善を導くことができた。
CPTXの設計原理を応用することによって、さまざまな神経回路におけるシナプス接続を導く新しい人工シナプスコネクターを開発することも可能であり、シナプスの形成・維持メカニズムの解明や、精神・神経疾患の新たな治療戦略の創出・応用につながることが期待される。
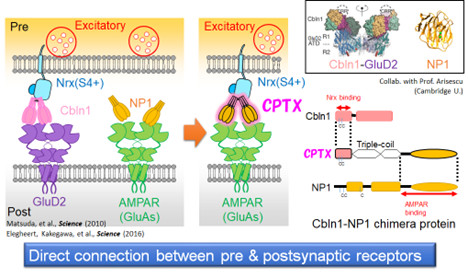
図3. 人工シナプスコネクターCPTXの設計
- “A synthetic synaptic organizer protein restores glutamatergic neuronal circuits” K. Suzuki, J. Elegheert, I. Song, H. Sasakura, O. Senkov, K. Matsuda, W. Kakegawa, A. J. Clayton, V. T. Chang, M. Ferrer-Ferrer, E. Miura, R. Kaushik, M. Ikeno, Y. Morioka, Y. Takeuchi, T. Shimada, S. Otsuka, S. Stoyanov, M. Watanabe, K. Takeuchi, A. Dityatev*, A. R. Aricescu*, M. Yuzaki*, Science, 369, eabb4853 (2020).
(注4)シナプス
神経細胞間の情報伝達に特化したつなぎ目。神経伝達物質が貯蔵・放出されるシナプスの前部から、それを受け取る受容体が存在する後部へ信号が伝えられる。興奮性シナプスでは、前部からグルタミン酸が放出され後部のグルタミン酸受容体を介して神経細胞を興奮させる性質がある。
(注5)シナプスオーガナイザー
シナプスを適切に構築する役割を担う分子を総称して呼ぶ。
特定オルガネラ脂質のケミカルラベリング法の開発
私たちヒトの細胞は脂質二重層からなる形質膜によって包まれ、その内側にはさらに核やミトコンドリアといった、脂質膜で形成される細胞内小器官(オルガネラ)が存在している。これら生体膜の主要構成脂質であるホスファチジルコリン(PC)は、主に細胞内の小胞体やゴルジ体で生合成された後、小胞輸送や膜接触など様々な経路を介して他のオルガネラ膜や形質膜に輸送される。こうしたPC輸送は細胞の機能や生存に重要だが、直接観察する方法が無かったため、これまで十分に理解できていなかった。
研究グループは、「オルガネラに局在する反応性試薬」と「PCの代謝的アジド化法」を組み合わせた独自のアイデアで、特定のオルガネラにあるPCを選択的に蛍光標識することに成功し、オルガネラ間PC輸送の可視化を世界で初めて実現した(図4)。
さらに、オートファジーの際に出現する膜の起源解明に本手法を適用し、小胞体膜がオートファゴソームにPCを供給する様子を生細胞内で直接観察することに成功した。本研究成果は、研究ツールの乏しさゆえに不明な点の多い細胞内脂質輸送機構の解明に向けた大きなブレークスルーにつながると期待される。
実際に、本手法を大規模CRISPR-KOスクリーニングシステム(注6)と組み合わせ、脂質の代謝・輸送を担う複数の責任遺伝子の同定に成功した(図5)。特にFLVCR1トランスポーターのコリン輸送機能は、世界で初めての発見であり、遺伝性神経疾患の要因として既知のFLVCR1の変異が、コリン取り込み活性喪失に由来することを解明するものである。
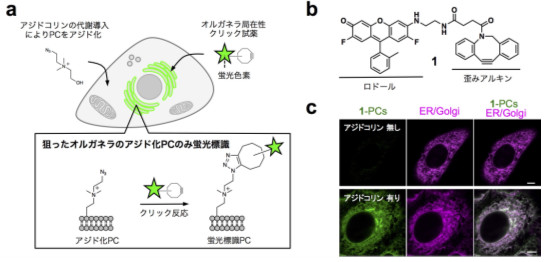
図4. (a) PCを選択的に蛍光標識する反応スキーム. (b) オルガネラ局在性クリック試薬1の分子構造.
(c) 1-標識PCの細胞内局在。
その局在は ER/Golgi マーカーと一致した。

図5. CRISPR KOスクリーニングとの組み合わせによる脂質の代謝・輸送を担う責任遺伝子の同定
- “Organelle membrane-specific chemical labeling and dynamic imaging in living cells” T. Tamura, A. Fujisawa, M. Tsuchiya, Y. Shen, K. Nagao, S. Kawano, Y. Tamura, T. Endo, M. Umeda, I. Hamachi*, Nature Chemical Biology, 16, 12, 1361-1367(2020).
- “Organelle-selective click labeling coupled with flow cytometry allows pooled CRISPR screening of genes involved in phosphatidylcholine metabolism” M. Tsuchiya, N. Tachibana, K. Nagao, T. Tamura*, I. Hamachi*, Cell Metabolism, 35, 1072-1083 (2023).
(注6)CRISPR-KOスクリーニング
2020年ノーベル化学賞の受賞テーマとなった遺伝子改変技術。CRISPR/Cas9と呼ばれる高効率のDNA切断酵素システムを利用して、細胞のゲノム(全ての遺伝子情報が書き込まれたDNA)に変異を導入し、特定の遺伝子の機能を欠失させる(KO:ノックアウト)ことができる。
CRISPR-KOスクリーニングでは、1個の細胞当たり1種類の遺伝子を欠損した細胞集団(ライブラリー)が利用され、ヒトゲノムの場合は約2万種類の遺伝子を対象とする。1億個程度の細胞ライブラリーから目的の生物学的特徴を示す細胞を数パーセントに選抜することで、その特徴を与える原因となった遺伝子変異を同定することができる。