
研究総括 岩田 想
(京都大学 大学院医学研究科 教授/インペリアルカレッジロンドン 分子生命科学科 教授)
研究期間:2005年9月~2011年3月
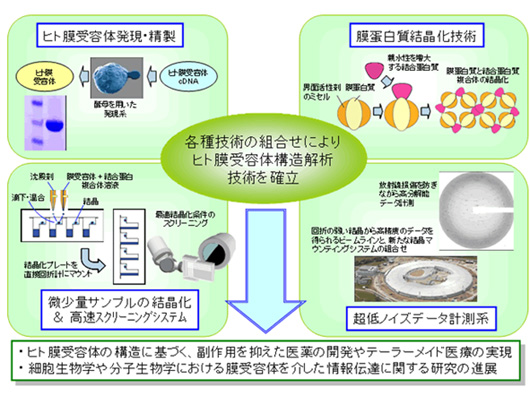
ヒトのG蛋白質共役受容体(GPCR)は医薬品の主要な標的であり、そのX線結晶構造解析は構造生物学にとって重要な課題です。プロジェクトの開始時、技術的に困難な点が構造決定に至る過程にあったため、1つもその構造が解かれていませんでした。プロジェクトでは(1)発現・精製(2)結晶化(3)データ測定という3つの領域の基盤技術開発を平行して実施し、開発した技術を用いてGPCRの構造解析を達成することを目指しました。なお、モデル膜蛋白質を技術開発の促進に利用しました。
Green Fluorescent Protein融合蛋白質としてGPCRを発現させる出芽酵母の系で、安定化変異体をスクリーニングし、メタノール資化性酵母又は昆虫細胞で大量培養を行い、機能を維持したGPCRを生産する方法を確立しました。リポソーム免疫法や抗体スクリーニング方法を開発し、GPCRの構造を認識し安定な複合体を形成する抗体を作成する方法を確立しました。この複合体を蒸気拡散法で結晶化する以外に、キュービック液晶法を導入しました。インペリアルカレッジと共同して放射光施設ダイアモンドでデータ測定法を開発し、最終的に3種類のGPCR、5種類のモデル膜蛋白質の構造解析に成功しました。
研究成果集
(1) 発現、精製
最初の構想ではメタノール資化性酵母Pichia Pastorisを主に用い、発現生産を行う予定であった。しかしながら、そのスクリーニングの速度/効率が十分でないことおよびGPCRによっては良好な品質の標品を得ることができない問題が明らかになり、以下の二つのシステムを加えて相補的に運用することを行った。
スクリーニングに関しては、インペリアルカレッジで外部協力研究員のDrewらによって開発された、出芽酵母Saccharomyces cerevisiae中でほ乳類輸送体をGreen Fluorescent Protein(GFP)との融合蛋白質として発現させる系をGPCRに適応し高速、高効率化を計った。蛋白質の品質の問題に関しては、不安定なGPCRに対してはより動物細胞に近い環境で発現の行える昆虫細胞の系を導入した。
また、生産した蛋白質をGFPの蛍光を利用した蛍光ゲル濾過法または非常に少量で迅速に膜蛋白質の熱安定性を測定できる(N-[4-(7-diethylamino-4-methyl-3-coumarinyl) phenyl]maleimideを用いたアッセイ(CPMアッセイ)等を用いて定量的に安定性を評価できる系を導入した。生産したGPCRおよびその各種の変異体から結晶化に適したものを迅速に選ぶことができる系を確立した。新規なClear Native電気泳動法も開発した。
- Fluorescence-based optimization of human bitter taste receptor expression in Saccharomyces cerevisiae. Sugawara T, Ito K, Shiroishi M, Tokuda N, Asada H, Yurugi-Kobayashi T, Shimamura T, Misaka T, Nomura N, Murata T, Abe K, Iwata S, Kobayashi T. Biochem Biophys Res Commun. 382(4), 704-710, 2009.
- Comparison of functional non-glycosylated GPCRs expression in Pichia pastoris. Yurugi-Kobayashi T, Asada H, Shiroishi M, Shimamura T, Funamoto S, Katsuta N, Ito K, Sugawara T, Tokuda N, Tsujimoto H, Murata T, Nomura N, Haga K, Haga T, Iwata S, Kobayashi T. Biochem Biophys Res Commun. 380(2), 271-276, 2009.
- Advanced method for high-throughput expression of mutated eukaryotic membrane proteins in Saccharomyces cerevisiae. Ito K, Sugawara T, Shiroishi M, Tokuda N, Kurokawa A, Misaka T, Makyio H, Yurugi-Kobayashi T, Shimamura T, Nomura N, Murata T, Abe K, Iwata S, Kobayashi T. Biochem Biophys Res Commun. 371(4), 841-845, 2008.
- 改変CBBを用いた新規Clear Native電気泳動法、特願2008-307507.芳香族スルホン酸化合物を用いた新規Clear Native電気泳動、PCT/JP2009/07019.
(2) 結晶化
膜蛋白質の結晶化の一般的な促進法の開発のために、膜蛋白質の構造を認識し安定な複合体を形成する抗体を用いて膜蛋白質の親水性部分を拡張する技術を開発した。ほ乳類膜蛋白質に対しマウスを用いて構造認識抗体を作成することは一般に難しいとされるが、新規の免疫方法および抗体スクリーニング方法を開発することにより、この技術を確立した。
抗体スクリーニングに関しては旧来通りハイブリドーマを使う方法、および抗体cDNAライブラリーからファージディスプレーを用いてスクリーニングをかける方法の両方を確立した。現時点ではハイブリドーマを用いた系の方が多くのターゲットに対し良好な抗体を作成することに成功しているが、ファージディスプレー系の最適化が進めば、抗体作成効率およびリコンビナント抗体の作成の上で大きなメリットがあると考えられる。
また、結晶化に関してスクリプス研究所のStevensらとの共同研究により、GPCRの細胞内第三ループをT4リゾチームに置き換え安定化し、キュービック液晶中で結晶化する方法を導入した。本法は受容体を基本的に不活性型に固定し、かつまたG蛋白質と相互作用する細胞内ループを取り除いてしまう。これらの点で細胞内情報伝達を調べるのには不適であるという限界があるが、分解の高い良好な結晶がとれることからアゴニスト/インバースアゴニストと受容体の複合体の構造を解析するのに適した系であると考えられる。
- 抗膜貫通型蛋白質抗体の抗原結合部位を決定する方法、特願2008-322607.
- 膜蛋白質の立体構造を認識するモノクローナル抗体のスクリーニング方法、特願2009-110994、PCT/JP2010/057631.
- 抗ヒトアデノシンA2a受容体モノクローナル抗体、特願2009-254463.
(3) データ測定
放射光施設ダイアモンドにおいては全自動結晶化システムと低ノイズのX線データコレクションシステムを組み合わせ、結晶の迅速スクリーニングと微結晶など難易度の高い結晶から高精度のデータを集める技術基盤を確立した。
結晶はダイアモンドのマイクロフォーカスビームラインを中心として構築されたデータ測定システムを用いて解析された。このシステムは8ミクロン程度までフォーカスしたマイクロビームをビデオ型の高速読み出し検出器(Pilatus)と組み合わせ、目に見えない微結晶を探すグリッドスキャン、反射が弱く放射線損傷が大きいがサイズが比較的大きな結晶に適したデータ測定法ラインスキャンなどの測定モードを組み合わせることのできる世界に例を見ないシステムである。これらを用い、新規GPCRおよび輸送体膜蛋白質の高難易度結晶の解析を数多くこなすことに成功した。
(4) 構造解析
上記の基盤技術を用いることにより、3種類のターゲットGPCRの構造解析に成功した。また、モデル膜蛋白質に関しても5種類の構造解析に成功し、2種類の構造解析を検討している。10種類のうち、抗体との複合体として結晶化されたものが5種類、キュービック液晶法で結晶化されたものが2種類と、開発・導入された技術が大きな効果をあげた。構想で示した創薬に重要な膜蛋白質の構造解析を達成することに成功し、さらに新技術を用いて多くのヒトGPCR/膜蛋白質の立体構造が解析されるようになると考えられる。
- Molecular basis of antihistamine specificity against Human Histamine H1 receptor. Shimamura T, Shiroishi M, Weyand S, Tsujimoto H, Winter G, Katritch V, Abagyan R, Cherezov V, Liu W, Han G.W, Kobayashi T, Stevens R.C., Iwata S. submitted.
- Molecular basis of G-protein coupled receptor inactivation by an antibody as an allosteric inverse agonist. Hino T, Arakawa T, Iwanari H, Yurugi-Kobayashi T, Ikeda-Suno C, Weyand S, Nomura N, Cameron A.D., Kobayashi T, Hamakubo T, Iwata S, Murata T. submitted.
- Molecular basis of alternating access membrane transport by the sodium-hydantoin transporter Mhp1. Shimamura T, Weyand S, Beckstein O, Rutherford NG, Hadden JM, Sharples D, Sansom MS, Iwata S, Henderson PJ, Cameron AD Science 328(5977), 470-473, 2010.
- Structure and molecular mechanism of a nucleobase-cation-symport-1 family transporter. Weyand S, Shimamura T, Yajima S, Suzuki S, Mirza O, Krusong K, Carpenter EP, Rutherford NG, Hadden JM, O’Reilly J, Ma P, Saidijam M, Patching SG, Hope RJ, Norbertczak HT, Roach PC, Iwata S, Henderson PJ, Cameron, AD Science 322(5902), 709-713, 2008.
- Structural Basis of Biological N2O Generation by Bacterial Nitric Oxide Reductase. Hino T, Matsumoto Y, Nagano S, Sugimoto H, Fukumori Y, Murata T, Iwata S, Shiro Y. Science 330(6011), 1666-1670, 2010.
研究成果
評価・追跡調査
※本プロジェクトは、ERATO研究期間終了後継続して、平成24年度~平成28年度まで研究加速強化システムによりJSTが支援を行いました(課題名「膜蛋白質構造基盤プロジェクト」)。