- JST トップ
- /
- 戦略的創造研究推進事業
- /
 ERATO
ERATO- /
- 研究領域の紹介/
- 終了領域/
- 沼田オルガネラ反応クラスタープロジェクト
沼田オルガネラ反応クラスタープロジェクト

研究総括 沼田 圭司
(京都大学 大学院工学研究科 教授/理化学研究所 環境資源科学研究センター チームリーダー)
研究期間:2016年10月~2023年3月
※本プロジェクトは、追加支援期間(ノーコストエクステンション型)の枠組みにより当初研究期間を(1年)延長し、2023年3月までJSTが支援を行うことになりました。
グラント番号:JPMJER1602
植物は、固有の細胞内小器官(オルガネラ)を持ち、光合成などの独自の物質生産を行っていることから、植物を用いた物質生産技術は、化学産業など、多様な産業への応用が期待されています。しかし、植物を用いた物質生産技術は実用化の段階には至っていません。その要因は、オルガネラ間の物質輸送や相互作用、それらが植物の物質生産能力に与える影響が未解明であることが挙げられます。また、現在の技術では、単一オルガネラの改変がようやく達成され始めたところであり、複数のオルガネラを自在に操作し、物質生産に最適な代謝経路を設計できる段階には到達していません。
本プロジェクトでは、工学と植物科学、バイオイメージングなど複数の学問分野が融合することにより、植物細胞中のオルガネラを複合的に操作・改変する技術を確立します。さらに、オルガネラ間の物質輸送やオルガネラの細胞内局在が物質生産に与える影響など、これまで未知であったオルガネラ間の相互作用を体系的に明らかにします。これにより、物質生産に最適な植物個体の作出や植物個体の機能改変に向けた基盤を構築し、植物を起点とした多様な産業へのイノベーションを創出することを目指します。
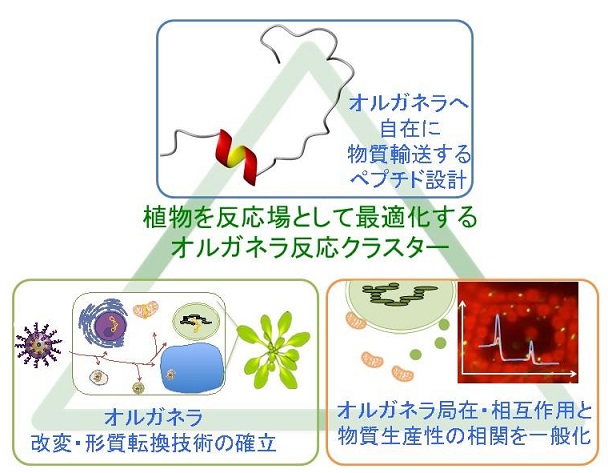
研究グループ
・融合ペプチド設計グループ
・オルガネラ改変グループ
・オルガネラ相互作用グループ
・融合ペプチド利活用グループ
研究および研究成果概要
本プロジェクトでは、オルガネラに選択的に物質輸送できるキャリアペプチドを創出し、核酸やタンパク質等の導入により複数のオルガネラを複合的に改変する技術を確立することを目標とした。また、細胞内のオルガネラ間距離と代謝反応の相関関係を数値化し、オルガネラ間の物質輸送や細胞内局在が物質生産に与える影響を総合的に明らかにすることを目指した。
特記すべき成果として、細胞壁を緩める双性型イオン液体とペプチド提示型ミセルを組み合わせた植物オルガネラへのDNA導入手法を確立した。
また、カーボンナノチューブをキャリアとして利用したミトコンドリアへの遺伝子送達法、およびペプチドによる物質送達をより広範かつ簡便に行うための新規手法としてスプレー法の技術も確立した。このほか、海洋性紅色光合成細菌を用いて、PHA生産及び人工シルク生産に取り組み、独立栄養培養条件におけるシルクタンパク質の発現とバクテリアセルロースの生合成に成功した。
本プロジェクトでは、多彩な分野からのアプローチで課題に取り組み、オルガネラの新しい形質転換法を創出することができた。
研究成果集
融合ペプチド設計グループ
プロジェクト期間内に達成する重点的なテーマとして植物オルガネラの改変へ向けた高効率な遺伝子導入を可能とするキャリアペプチドの開発と導入手法の確立に取り組んだ。植物細胞内の各オルガネラ、特に3種の主要オルガネラ(核、葉緑体、ミトコンドリア)への遺伝子導入効率の向上を指向した新規キャリアペプチドを開発し、様々なオルガネラへの選択的な物質移行を可能とするオルガネラ移行配列の開発と遺伝子導入効率を含めた機能改善に向けた機能性ペプチドの開発に重点を置いて研究を進めた。これまでに、核・葉緑体・ミトコンドリアに特異的に物質輸送することができるペプチドとしてそれぞれNLS(PKKKRKV)、AtOEP34(MFAFQYLLVM)、Cytcox(MLSLRQSIRFFK)が最適な移行配列であることを見出しており、これらの配列を含むキャリアペプチドからなるペプチド/DNA複合体を用いた植物への遺伝子導入により、オルガネラ選択的な遺伝子の送達と発現に成功している。また、導入効率の向上を目的として細胞透過性ペプチドの改良も同時に進めてきており、新しい分子設計の元に合成した新規ペプチドを含めた機能性ペプチドの最適な組み合わせからなるキャリアペプチドにより、従来の2倍程度の遺伝子導入効率を達成した。
代表論文
- Polymer-coated carbon nanotube hybrids with functional peptides for gene delivery into plant mitochondria. SSY Law, G Liou, Y Nagai, J Giménez-Dejoz, A Tateishi, K Tsuchiya, Y Kodama, T Fujigaya, K Numata. Nat. Commun. , 2022; 13(1): 2417
- Endosome-escaping micelle complexes dually equipped with cell-penetrating and endosome-disrupting peptides for efficient DNA delivery into intact plants. T Miyamoto, K Tsuchiya, K Numata. Nanoscale , 2021; 13: 5679-5692
- Peptide-based polyion complex vesicles for the delivery of enzyme into intact plants for the addition of antibiotic resistance without genetic modifications. S Fujita, Y Motoda, T Kigawa, K Tsuchiya, K Numata. Biomacromolecules , 2020; 22(3): 1080-1090
オルガネラ改変グループ
キャリアペプチドを用いた複数オルガネラの改変を目指し、改変に適した組織培養技術を開発するほか、キャリアペプチドの選択性や効率性を高めることを目的とした植物培養細胞における各種条件の最適化にも取り組んだ。第一ステップとして、葉緑体移行配列OEP34とポリカチオン性ペプチドの繰り返し配列であるKH9を融合したKH9-OEP34を用いた葉緑体へのプラスミドDNAの送達に成功した。また、細胞透過性ペプチド(CPP)付加によってこの送達の効率が顕著に上昇すること、葉緑体に限らず様々な植物の様々な形態の色素体に適用できることを明らかにした。既に開発済みのCytcox-KHによるミトコンドリアへの遺伝子送達法と併せて、キャリアペプチドによるオルガネラへの遺伝子送達の基盤を形成することができた。さらに、葉緑体とミトコンドリア選択的なコンストラクトDNAのゲノムへの一過的な組み込みをin plantaで成功した。オルガネラ形質転換に用いる全ての植物に関しては、遺伝子導入に適したそれぞれの組織を選定し、ケナフに関してはさらに個体再生系を確立した。これらの組織培養技術とKH9-OEP34による葉緑体選択的な遺伝子送達を組み合わせることで、イネ、ケナフ、タバコ全ての植物において安定的な葉緑体形質転換体の作出に成功した。またこれらの葉緑体形質転換体では、ヘテロプラスミックに改変されたゲノムが次世代にも継承されていることが確認された。ミトコンドリアに関しては、Cytcox-KHを用いた系において、シロイヌナズナとタバコにおける一過的なコンストラクトの組み込みを確認し、葉酸合成系阻害剤sulfadiazineと耐性遺伝子sulを用いた選抜システムを確立した。また植物専用のミトコンドリア移行ペプチドPMTPを利用した遺伝子送達系も確立した。一方で、融合ペプチド設計グループにより確立されたペプチド修飾カーボンナノチューブによるミトコンドリア遺伝子送達系を利用してコンストラクトDNAを効率的にミトコンドリアゲノムに組み込み、ミトコンドリアの代謝を改変することに成功した。派生プロジェクトとして、効率的な物質送達を目指した新規送達法(スプレー法)の開発を行い、スプレー法で噴霧することにより葉緑体ゲノムへのコンストラクトDNAの一過的な挿入に成功するとともに、非組換えの効率的な植物改変法として確立した。
代表論文
- Functional peptide-mediated plastid transformation in tobacco, rice, and kenaf. M Odahara, Y Horii, J Itami, K Watanabe, K Numata. Front. Plant Sci. , 2022; 13:989310
- Non-transgenic gene modulation via spray delivery of nucleic acid/peptide complexes into plant nuclei and chloroplasts. C Thagun, Y Horii, M Mori, S Fujita, M Ohtani, K Tsuchiya, Y Kodama, M Odahara, K Numata. ACS Nano , 2022; 16(3): 3506-3521
- Targeted gene delivery into various plastids mediated by clustered cell-penetrating and chloroplast-targeting peptides. C Thagun, JA Chuah, K Numata. Adv. Sci. , 2019; 6(23): 1902064
オルガネラ相互作用グループ
1.オルガネラ間相互作用の解析 2.代謝産物のイメージング解析 3.オルガネラの局在と相互作用を制御する新技術の開発 4.植物細胞内外における融合ペプチドの挙動解析の4つの研究を行った。
オルガネラ間相互作用の解析では、電界放出型走査電子顕微鏡(FE-SEM)を用いた1細胞丸ごと電子顕微鏡イメージング技術および三次元再構築技術を確立した。光合成との関連を調べるために明暗条件の比較実験を行った結果、光環境下ではペルオキシソームが肥大化する一方でミトコンドリアは断片化し、葉緑体と3者複合体を形成することがわかった。共焦点レーザー顕微鏡を用いた複数オルガネラ(葉緑体ーペルオキシソーム、葉緑体ーミトコンドリアなど)の同時蛍光イメージングにも成功し、細胞内のオルガネラの局在や相互作用を数値として表す汎用的なオルガネラ局在指数を確立した。代謝産物のイメージング解析については、ラマンシグナルを発するアルキンタグの付いた市販の脂肪酸を用いたラマンイメージングを確立しただけでなく、汎用性のある新しいラマンラベリング技術を確立した。オルガネラの局在と相互作用を制御する新技術の開発については、オルガネラの局在や相互作用を顕微鏡下で制御する技術として、温度や光を制御可能な顕微鏡部品を開発した。またオルガネラの局在や相互作用を人工制御する技術としては、分割蛍光タンパク質の再構成反応を利用し、葉緑体を団子状に相互作用させることに成功した。植物細胞内外における融合ペプチドの挙動解析について、融合ペプチドが細胞内で機能するまで存在する4つの障壁(組織、細胞壁、細胞膜、細胞内分解)に対する融合ペプチドの挙動については、すべて解明した。組織については葉や根に着目した蛍光イメージング、細胞壁と細胞膜については高速原子間力顕微鏡(HS-AFM)を用いたナノメータースケールイメージング、細胞内分解については蛍光イメージングと生化学実験の組み合わせで解明した。
代表論文
- Mitochondrial movement during association with chloroplasts in Arabidopsis thaliana. K Oikawa, T Imai, K Toyooka, T Yoshizumi, K Ishikawa, Y Kodama, K Numata. Commun. Biol. , 2021; 4: 292
- Three-dimensional nanoscale analysis of light-dependent organelle changes in Arabidopsis mesophyll cells. K Midorikawa, A Tateishi, K Toyooka, M Sato, T Imai, Y Kodama, K Numata. PNAS Nexus , 2022; pgac225
- Organellar glue: A molecular tool to artificially control chloroplast-chloroplast interactions. S Ichikawa, S Kato, Y Fujii, K Ishikawa, K Numata, Y Kodama. ACS Synth. Biol. , 2022; doi.org/10.1021/acssynbio.2c00367
融合ペプチド利活用グループ
幅広い生物種に対するペプチドの応用可能性を探索するべく、主に融合ペプチド設計グループにより開発された各種キャリアや導入系を、植物のみならず大腸菌や紅色光合成細菌、緑藻、褐藻、動物細胞などの多岐にわたる生物種へ応用する研究を展開した。
大腸菌への遺伝子導入では、融合ペプチドと巨大DNA(205Kb)を複合化することで巨大DNAの大腸菌への導入が可能となり、遺伝子クラスター導入のための技術基盤の構築に成功した。一方、マクロピノサイトーシス誘起ペプチド(dTat-Sar-EED)が広範な生物種(タバコBY-2細胞・イネ・シロイヌナズナ・ユーグレナ・クラミドモナス・ゼニゴケ)へのタンパク質およびDNA導入に有用であることを明らかにした。さらに輸送経路の阻害実験や透過型電子顕微鏡による観察から、dTat-Sar-EEDがマクロピノサイトーシスと類似する機構を誘起していることが植物細胞において初めて明らかとなった。
またdTat-Sar-EEDの利用により、海洋性の紅色光合成細菌を高効率に形質転換する技術を開発した。我々は紅色光合成細菌を持続可能な生産宿主として利用することを目的として、種々のバイオ高分子(PHA・シルクタンパク質・バクテリアセルロース)の生物生産に取り組み、紅色光合成細菌のPHA生産に関わる因子の同定、PHA高生産株の単離、独立栄養培養条件におけるシルクタンパク質の発現とバクテリアセルロースの生合成に成功した。さらに、合成高分子から成るナノゲル粒子を紅色光合成細菌と共培養させることで、PHAの生産量を約157倍に高めることにも成功した。
形質転換技術が未整備である褐藻や動物ミトコンドリアにおいて、高効率な核酸送達を可能にするため、我々は褐藻の細胞表面に存在するボロン酸輸送体に注目して末端にボロン酸を修飾した融合ペプチドを褐藻特化型のキャリアとして開発した。このボロン酸修飾ペプチドをsiRNA(small interfering RNA)と複合化してモデル褐藻のシオミドロへ投与したところ、ボロン酸輸送体に認識された複合体が高効率に細胞内へ取り込まれることが明らかとなった。また、導入したsiRNAが誘導する遺伝子サイレンシングによって、オーキシンの生合成が阻害されることが示唆された。
代表論文
- A marine photosynthetic microbial cell factory as a platform for spider silk production. C P Foong, M Higuchi-Takeuchi, AD Malay, NA Oktaviani, C Thagun, K Numata. Commun. Biol. , 2020; 3, 357
- A Synthetic Multidomain Peptide That Drives a Macropinocytosis-Like Mechanism for Cytosolic Transport of Exogenous Proteins into Plants. T Miyamoto, K Toyooka, JA Chuah, M Odahara, M Higuchi-Takeuchi, Y Goto, Y Motoda, T Kigawa, Y Kodama, K Numata. JACS Au , 2022; 2(1), 223-233
- Engineered nanogel particles enhance the photoautotrophic biosynthesis of polyhydroxyalkanoate in marine photosynthetic bacteria. P Srisawat, M Higuchi-Takeuchi, R Honda, T Shirai, A Kondo, Y Hoshino, K Numata. ACS Sustain. Chem. Eng. , 2022; 10(13), 4133-4142









