成果概要
ウイルス-人体相互作用ネットワークの理解と制御[2] 宿主応答ネットワークの解析
2024年度までの進捗状況
1. 概要
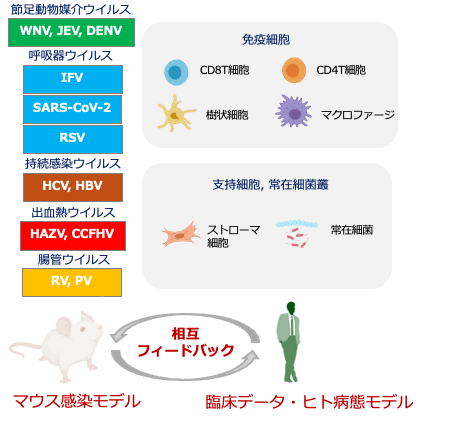
各種ウイルス感染モデルを用い、エフェクターT細胞、記憶T細胞、マクロファージ、樹状細胞などの自然免疫細胞の遺伝子発現を単一細胞レベルで解析し、数理・イメージング研究者と連携して応答パターンの可視化と数理モデル化を進めています。2024年度は、加齢や病態によって異なる免疫応答や、マクロファージや好中球において特徴的な動態をあらわすタンパク質群などの鍵分子の機能を明らかにしました。また、ケモカイン制御機構や、腸内細菌の変動が感染重症化と関係することも示されました。
さらに、ヒト検体を用いた解析では、加齢に伴う免疫応答の変化や、ワクチン接種後の免疫細胞の反応差を明らかにし、動物モデルとの対応関係も検討しました。これらをもとに、免疫細胞・支持細胞・マイクロバイオームのネットワーク解析を進め、個別化予防や新たな治療戦略の基盤構築を目指しています。
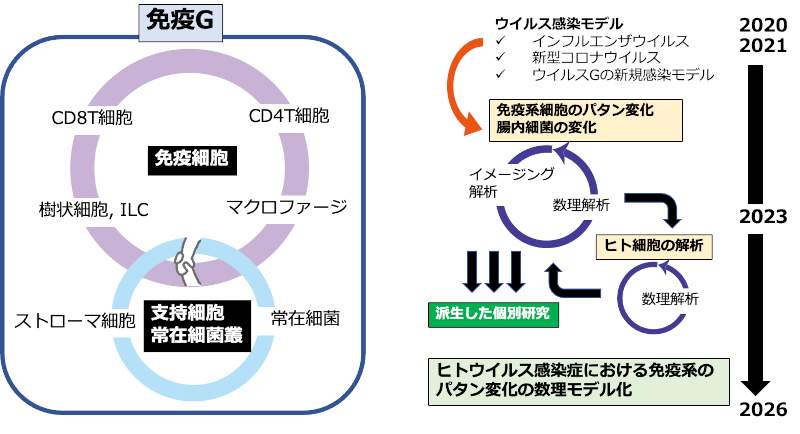
2. これまでの主な成果
2024年度は、免疫細胞や腸内細菌がウイルス感染にどのように応答し、症状の軽重に関与するかを網羅的に解析、宿主応答ネットワークのパターン化を進めました。特に、加齢や体質の違いによって免疫応答に差が生じること、また感染前から存在する細胞状態や腸内細菌叢の構成が、感染拡大や重症化リスクに大きく影響することが明らかとなりました。これにより、感染初期における個別リスクの予測が可能となると期待され、将来的には個別化された予防法や早期介入型の新たな治療戦略の確立につながると考えられます。
また、ウイルス感染における2型自然リンパ球(ILC2)の動態と機能を解明しました。ILC2は感染局所において活性化され、上皮細胞や間質細胞との相互作用を通じて、組織保護や免疫制御に関与することが示されました。本研究により、ILC2が感染防御の重要な調節因子であることが示唆されました。
これらの成果は、アレルギーをはじめ、老化や肥満といったヒト病態とウイルス感染との相関を明らかにするための基盤となることが期待されます。
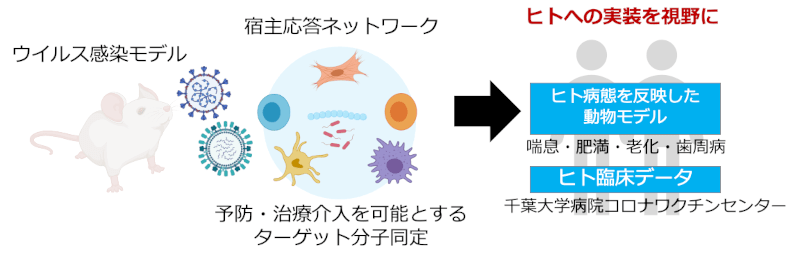
3. 今後の展開
今後は、動物モデルとヒト検体の解析をさらに統合し、ウイルス感染に対する個人差の背景にある分子メカニズムをより詳細に明らかにしていきます。免疫細胞や腸内細菌叢、支持細胞のネットワークの変化を時系列で可視化・モデル化することで、感染の超早期段階におけるリスク予測の精度を高めることを目指します。また、得られた知見を活用し、年齢や体質に応じた個別化予防法や、症状が現れる前に介入できる新たな治療戦略の提案へとつなげていきます。