成果概要
臓器連関の包括的理解に基づく認知症関連疾患の克服に向けて[5] AI・数理研究による臓器間ネットワークの解明
2024年度までの進捗状況
1. 概要
AI・数理研究を通じて、異種データ統合機械学習システムの開発、各研究グループとの連携によるデータ駆動的な臓器間ネットワークの数理モデル構築を行います。そして数理モデルとヒトデータの統合を通じて、数理学的手法による臓器間ネットワークの解明を目指します。
異種データ統合システムでは、生物から得られる限りあるデータを有効に活用するため、AI・機械学習を用いて、例えばデータのノイズを除去したり欠損値を補ったりすることを可能とします。データ駆動的な数理モデル構築では、生物から得られたデータを用いて病態を推定することや、データから各臓器の状態を予測可能にするような数理モデルの構築を目指します。そして数理モデルとヒトデータとの統合では、未病状態で非侵襲的かつ安価で計測できるデータから多臓器の状態、そして認知症発症に至る過程を推定する機械学習技術を開発します。
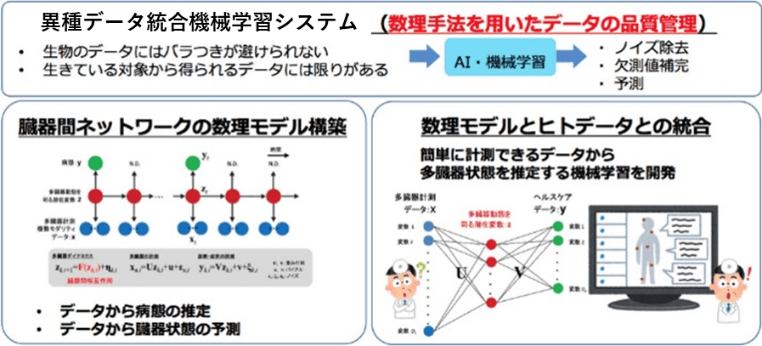
2. これまでの主な成果
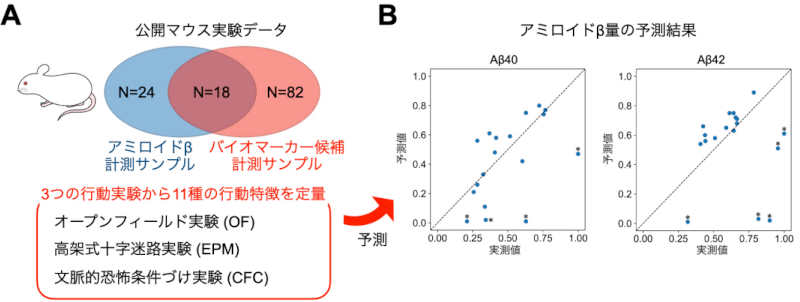
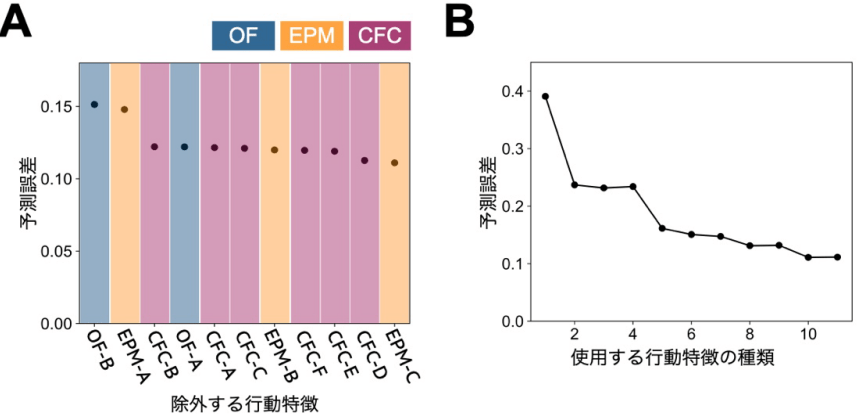
アルツハイマー病(AD)の予兆候補の発見に役立つ機械学習モデル開発
ADは、脳の神経細胞が徐々に変性する進行性の認知症疾患ですが、神経細胞の変性に先立ってアミロイドβ(Aβ)と呼ばれるタンパク質の蓄積が生じます。脳内のアミロイドβの蓄積を判定する方法は、現状ではコストや侵襲性などの問題があり、脳内のAβの蓄積量を予測できる、簡便で非侵襲に計測可能なバイオマーカーが待ち望まれています。本田直樹 名古屋大学教授、矢田祐一郎同特任助教からなる研究グループは、非侵襲的マーカーからAβ蓄積量の定量的予測を可能にする機械学習モデルを開発しました。今後、この技術を応用することで、Aβ蓄積量の予測性に基づいた新たなADバイオマーカーが開発されることが期待されます。(npj Systems Biology and Applications, 2023)
生体データのバッチ効果を消去する手法の開発
生体データには測定時期や機器、試薬ロットなどの非生物学的要因によるバッチ効果が含まれ、特に多施設研究や時系列データでは顕著であり、正しい生物学的解釈のためには、バッチ効果の除去が不可欠です。
名古屋大学・本田直樹教授、坂口峻太特任助教、堤真人特任助教らは、深層生成モデルを利用しバッチ効果を分離・補正する手法を開発しました。(BioRxiv, 2025)

本手法は多施設でのデータや臓器間の連関を含めた時系列データの正確な評価につながることが期待されます。
最適輸送理論を用いた臓器連関の推定
多臓器の単一細胞時系列データを用いた臓器連関の推定を可能とする手法を用いて、認知症疾患を含めた脳と多臓器の連関が見えてきました。
3. 今後の展開
上記は数理解析あるいは数理モデルの有用性を示すごく一部の例です。ムーンショット目標2では様々なモダリティ、例えば多数の臓器の単一細胞解析や認知症ヒトコホートの画像データなどビックデータが蓄積されつつあります。数理の力なくしてその解析は困難であり、さらには新しい理論やモデルの構築も必要であり、そのためには数理と生物の協働が不可欠です。