成果概要
臓器連関の包括的理解に基づく認知症関連疾患の克服に向けて[1~4] アルツハイマー病・血管性認知症・パーキンソン病関連認知症における脳-臓器連関の研究
2024年度までの進捗状況
1. 概要
認知症の原因となる三大疾患は、アルツハイマー病(AD)、血管性認知症(VD)、パーキンソン病(PD)関連認知症(レビー小体型認知症(DLB)を含む)です。本項目ではこれらの認知症について、最先端のモデルマウスとヒトコホート(MAABコホート、J-PPMIコホート、ながはまコホートなど)を用い、数理解析などを駆使して特に未病期における臓器間のつながり(臓器連関)を解明します。これによりリスク予見法の開発と介入による発症予防を目指します。
本研究で用いるモデルマウスは、原因タンパクが蓄積し(いわゆる‘未病’の状態)、その後に不可逆な神経症状を来すモデルで、各種病態の発症前段階の解析を可能とします。ヒトコホートも発症前からの集団を対象とした研究を推進しています。
- アルツハイマーグループ統括 山中宏二(名古屋大学)
- 血管性認知症グループ統括 望月直樹(国立循環器病センター)
- パーキンソン病グループ統括 服部信孝(順天堂大学)
- 基礎技術グループ統括 大塚稔久(山梨大学)
2. これまでの主な成果
認知症未病大規模多施設コホートの運営、活用
画像と血液のバイオマーカー開発を相互促進的に推進する多施設連携体制として、量子科学技術研究開発機構の樋口真人所長らが運営する全国18施設が参画するMABB(multicenter alliance for brain biomarkers)コホートがあります。各施設における他の臨床研究からもデータ・サンプルの二次利用が可能であることがMABB研究の特長で、これにより未病期を含めたバイオマーカーの検証を加速することができると期待されます。
この未病コホートでは、新たなより包括的な認知症の分類であるProVEN分類を中心とした解析を行っています。すなわち、アミロイドβ、タウなどの病的蛋白質(Protein)、脳内炎症環境(Environment)、血管病変(Vascular)、神経変性(Neurodegeneration)を生体液バイオマーカー、MRI、PETなどを駆使して解析するものです。

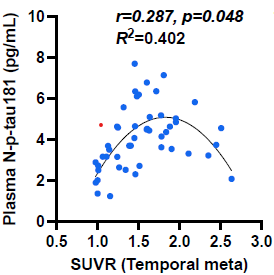
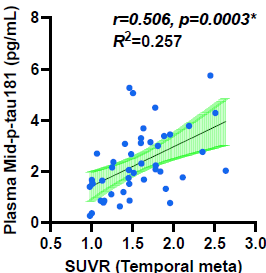
このうちADにおいて蓄積し神経障害と相関するとされる、最も重要なマーカーの一つであるリン酸化タウの血液を用いた新たな高感度検出系を開発しました(Transl Neurodegener, 2024)


αシヌクレイン(αSyn)を可視化する新たなPETの開発
パーキンソン病(PD)やレビー小体型認知症(DLB)は、αSynというタンパク質の病的な凝集体により神経細胞死を引き起こします。これまで凝集αSynを可視化するPETは長年待ち望まれていたものでしたが、量子科学技術研究開発機構の樋口真人所長らは世界に先駆けてこれを開発し、PDやDLBの患者で病変を検出しました(Neuron, 2024)

3. 今後の展開
今後は、様々な種類のデータを独自の疾患モデルや認知症「未病」コホートから収集します。さらにデータ駆動的な臓器間ネットワークの数理モデル解析を通じて、早期診断に資するバイオマーカー候補を抽出します。これにより、脳-臓器連関に基づく認知症の予測・予防を目指します。