個別事業紹介
幹細胞治療開発領域
研究課題名
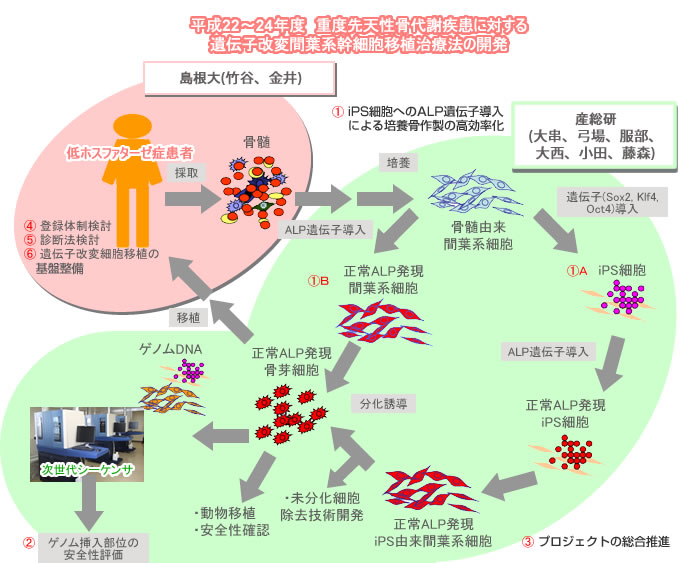
実施体制
研究代表者
| 弓場 俊輔 | (独立行政法人 産業技術総合研究所 健康工学研究部門 組織・再生工学研究グループ 研究グループ長 ) |
分担代表研究者
| 竹谷 健 | (島根大学医学部附属病院輸血部 講師) |
概 要
低ホスファターゼ症は組織非特異型アルカリホスファターゼ(ALP)の遺伝子変異による遺伝性疾患で、特に重症度の高い周産期型で全身の骨形成が障害され、呼吸筋を支える肋骨などが骨折するために呼吸不全で生後早期に死亡する。これまでに有効な治療方法がなかったが、近年、健常人の骨髄、間葉系幹細胞等を移植することにより、患者が救命されたというケースが報告された。産業技術総合研究所セルエンジニアリング研究部門では、本疾患に対して島根大学と共同で2004年に3度にわたって患者父親の培養間葉系幹細胞移植をおこなった。また、いままで報告のない間葉系幹細胞から分化させた骨芽細胞の移植治療も同症例におこなった。移植から一年以上経過した後でも患者骨片よりドナー由来の遺伝子が検出され、延命効果が見られた。しかし、ドナー遺伝子のシグナルはきわめて微量であり、患者の長幹骨の変形、脆弱性は残存して根治治療にはほど遠い。すなわち、同種(本症例では父親)の細胞を用いるには限度がある。
そこで、間葉系幹細胞からiPS細胞を樹立し、ALP遺伝子を導入した後、骨芽細胞に分化させ移植することで、低ホスファターゼ症患者の根治的治療をおこなうことを本研究開発の目的とする。ただし、現段階では、iPS細胞由来の細胞を用いる点で腫瘍形成を否定できない。そこで、その前段階として患者間葉系幹細胞に正常ALP遺伝子を導入した細胞を用いての骨形成の検証を行い遺伝子導入細胞治療の技術開発を行う。また、根治治療を目指して、患者細胞からiPS細胞を作製し、正常ALP遺伝子を導入した後、間葉系幹細胞もしくは骨芽細胞を分化誘導する。なお、種々の遺伝子がレトロウイルス等を用いて導入されるが、挿入部位によっては細胞機能に悪影響を及ぼす可能性もある。そこで次世代シーケンサを用いて、導入遺伝子のゲノム挿入部位を特定し、ゲノム挿入部位の安全性を評価する。以上の方法により、安全性の高いALP遺伝子導入細胞を早期に作製できる。なお、我々は同種の細胞を用いて、すでに間葉系幹細胞の投与法ならびに間葉系幹細胞から骨芽細胞への分化・移植法を確立している。そこで、本計画でもこれらの経験に基づく分化手段ならびに投与方法を検証する。
最終的には患者由来iPS細胞にALP遺伝子を導入し、さらに安全性を担保する治療技術開発をおこなうが、プロトタイプの治療技術として厚労省のヒト幹細胞指針への対応を可能にすべく、患者間葉系幹細胞に正常ALP遺伝子を導入して、安全に患者に用いられる技術開発もおこなう。
平成22年度の計画と目標
1.iPS細胞へのALP遺伝子導入による培養骨作製の高効率化 すでに確立した健常人間葉系幹細胞からのiPS細胞作製法を基に、患者間葉系幹細胞からiPS細胞を樹立する。また、樹立済みの健常人間葉系幹細胞由来iPS細胞から間葉系幹細胞、さらに骨芽細胞への分化誘導法の検討を行い、in vitroで石灰化能を有する骨芽細胞を作製する。
2.ゲノム挿入部位の安全性評価 低ホスファターゼ症患者由来間葉系幹細胞へレトロウイルスを用いてALP遺伝子を導入し、得られたALP遺伝子定常発現細胞株のレトロウイルス挿入部位を網羅的に検索する。
3.プロジェクトの総合推進 プロジェクトで得られた成果は積極的に公表し、今後の展開に資する。
4.登録体制の検討 各関連学会および患者の会と連携して登録体制の整備を行う。また、学会報告や講演、論文発表による本疾患の啓発、疫学調査による詳細な臨床像の把握を継続して行う。
5.診断法の検討 本疾患の生化学検査、遺伝子解析を行い、迅速かつ正確な診断および病態解明に取り組む。これらのデータを臨床像と比較し、細胞治療の適切な方法や時期を検討する。
6.遺伝子改変細胞移植治療の実施に向けた基盤整備 本疾患に対する同種間葉系幹細胞移植を行うことで、遺伝子治療および細胞治療を臨床応用するための問題点を明らかにし、その解決策を検討する。
研究成果・進捗
本プロジェクトでは低ホスファターゼ症治療法の確立を目指し、患者由来iPS細胞から間葉系幹細胞または骨芽細胞を分化誘導し、本疾患の根治治療技術開発を目的とする。本年度は以下の成果を得た。
1:iPS細胞へのALP遺伝子導入による培養骨作製の高効率化
産業技術総合研究所健康工学研究部門では、島根大学と共同で、低ホスファターゼ症患者に対する同種の培養間葉系幹細胞を用いての移植治療をおこなってきた。この治療により移植から一年以上経過した後でも患者骨片からドナー由来の遺伝子が検出され、延命効果がみられたが、患者の長幹骨の変形、脆弱性は残存している為、より根本的な治療が必要である(J Pediatr. 2009 Jun;154(6):924-30)。そのため、まず患者間葉系幹細胞を増殖し、レトロウイルスにより正常ALP遺伝子を導入した。遺伝子導入患者由来間葉系幹細胞を骨分化培養し、ALP染色、Arizarin red S染色、生化学的解析、RT-PCR等により遺伝子導入細胞がin vitroで骨化能を回復していることが確認された。(Gene Ther. 2010 Apr;17(4):494-502.図1参照)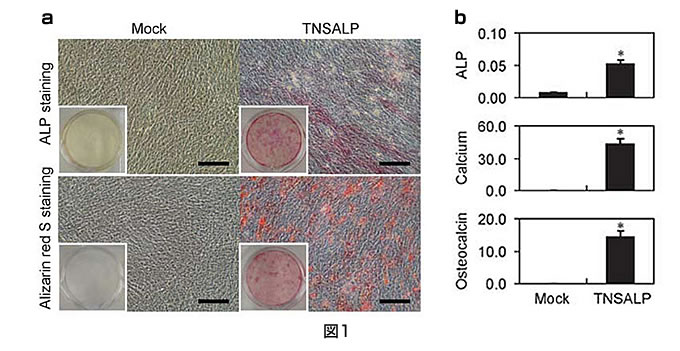 しかし、このALP遺伝子導入された細胞の骨化能は一過性であることが示唆されたため、より永続的な方法を模索する必要が生じた。そこで、近年開発されたiPS細胞樹立法を用いて、患者間葉系幹細胞からiPS細胞を作成し、このiPS細胞にALP遺伝子を導入した後、間葉系幹細胞に分化誘導する計画をたてた。その前段階として健常人、骨髄・脂肪・歯胚由来の間葉系幹細胞にレトロウイルスベクターを用いてOCT3/4, SOX2, KLF4, c-MYCの4因子またはc-MYCを除く3因子を導入し、ヒトES細胞様コロニーを得た。これらの細胞についてALP染色及び未分化マーカーの発現を検出し、未分化性を保持していることを証明した。さらに、in vitro及びin vivoでの三胚葉分化を確認し、多分化能を保持していることを証明した。これらの検証により間葉系幹細胞からiPS細胞を樹立するための基本技術が確立された(J Biol Chem 2010 Jul 1.[Epub ahead of print], Tissue Eng Part A. 2010 Jul;16(7):2197-206図2参照)。
しかし、このALP遺伝子導入された細胞の骨化能は一過性であることが示唆されたため、より永続的な方法を模索する必要が生じた。そこで、近年開発されたiPS細胞樹立法を用いて、患者間葉系幹細胞からiPS細胞を作成し、このiPS細胞にALP遺伝子を導入した後、間葉系幹細胞に分化誘導する計画をたてた。その前段階として健常人、骨髄・脂肪・歯胚由来の間葉系幹細胞にレトロウイルスベクターを用いてOCT3/4, SOX2, KLF4, c-MYCの4因子またはc-MYCを除く3因子を導入し、ヒトES細胞様コロニーを得た。これらの細胞についてALP染色及び未分化マーカーの発現を検出し、未分化性を保持していることを証明した。さらに、in vitro及びin vivoでの三胚葉分化を確認し、多分化能を保持していることを証明した。これらの検証により間葉系幹細胞からiPS細胞を樹立するための基本技術が確立された(J Biol Chem 2010 Jul 1.[Epub ahead of print], Tissue Eng Part A. 2010 Jul;16(7):2197-206図2参照)。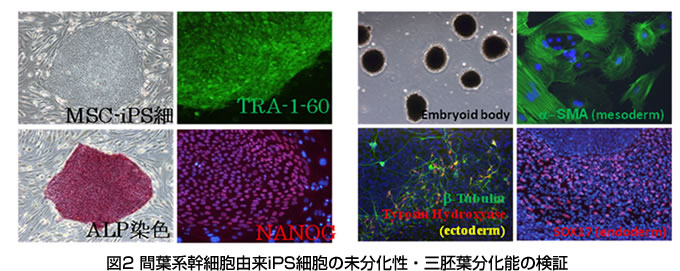
2:ゲノム挿入部位の安全性評価
レトロウイルス等を用いた遺伝子導入では挿入部位によっては細胞機能に影響を及ぼす可能性がある。そこで次世代シーケンサを用いた導入遺伝子のゲノム挿入部位同定を検討している。次世代シーケンサのセットアップを行い、ゲノム配列を効率的・高精度に解析するために必要な基盤技術開発を行った。まず市販細胞にレトロウイルスベクターによりALP遺伝子を導入したALP定常発現株を用いて、実際にシーケンスランを行い、得られたデータから挿入部位を決定するインフォマティクス解析を行った結果、2箇所に挿入されていることを確定することができた。また、この結果はクローニング・サンガー法で解析した結果と一致した。これにより次世代シーケンサを用いた遺伝子導入部位検索の基礎技術が確立された。3:プロジェクトの総合推進
日本再生医療学会でのシンポジウム3件を含む多数の成果報告活動を行なった。4:登録体制の検討(島根大学)
全国520施設の小児専門機関にアンケート調査を行い、本疾患患者の詳細な臨床経過を検討し、生命予後不良な周産期型の中に、予後良好な集団が存在することを見出した。5:診断法の検討(島根大学)
患者末梢血からALP遺伝子変異を同定する体制を整え、本疾患により有効なALP活性測定法を検討し、今回予後不良となるALP遺伝子変異型を明らかにした。6:細胞移植治療の実施に向けた基盤整備 (島根大学)
小児科を中心に、細胞移植治療チーム、骨代謝チーム、新生児医療チームを作り、まずは、本疾患に対する同種間葉系幹細胞移植遂行の為の適切な細胞治療プロトコールの検討、倫理委員会での検討等の整備を行った。今後の計画
リンク情報
http://unit.aist.go.jp/hri/group/hri-terg/●
http://www.med.shimane-u.ac.jp/pediatrics/alp.html●
