Research system
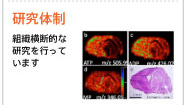
研究体制
生体ガス分子の未知の応答機構を系統的に理解するために、ナノビーズテクノロジーを駆使したタンパク質精製技術により、新たなガス応答分子の網羅的な探索を行うことにより、その分子機構の解析を行っています。また、この知見を基盤として、メタボローム技術を組み合わせる事により、生体内の代謝システム制御機構の解明を目指します。


ガス分子が生体内で感知・受容されることにより惹起される種々の生体分子の構造修飾・機能変化を、生きたままの状態で可視化するための基盤を構築し、ガス分子依存性代謝制御ポイントの探索することを研究目的としています。そのため、多機能多光子生体顕微鏡、顕微質量分析法などの先端技術を駆使すると同時に、金属微粒子配列技術を活用した生細胞内のガス分子イメージング技術やガス感受性バイオプローブの開発も目指します。


ガスバイオロジーの研究成果を医学・創薬研究に展開するためには、ヒトにフィードバック可能な薬理薬効評価系の構築、ガス分子の運搬・受容・分解に直接および間接的に作用して病態を制御できる化合物の探索、が不可欠であります。従来の実験動物を用いた評価系に加え、ヒト由来の細胞を体内に組織的に再現したhumanized animalを活用し、ガス分子関連医薬の開発を戦略的に実施します。

A joint research
共同研究 1) 東京工業大学生命理工学研究科/半田 宏 教授
1) 東京工業大学生命理工学研究科/半田 宏 教授- 新規ガス受容体探索のためのナノアフィニティビーズの供給。これを用いたスクリーニング。
 2)京都大学基礎医学系分子生体統御学講座/小林 拓也 講師
2)京都大学基礎医学系分子生体統御学講座/小林 拓也 講師- 各種ガス関連タンパク質のX線結晶解析
 3)北海道大学理学部化学分野/石森 浩一郎 教授
3)北海道大学理学部化学分野/石森 浩一郎 教授- 新規ヘムタンパク質のガス応答機構における分光・構造学的解析
 4)Johns Hopkins University(JHU)/Greg Semenza 教授
4)Johns Hopkins University(JHU)/Greg Semenza 教授- 低酸素応答の基礎的、応用的な解析。
 5)富士フィルム株式会社
5)富士フィルム株式会社- 金・銀薄膜を用いた含硫ガス検出システムおよび、ラマン分光イメージングの基盤技術の開発。
 6)慶應義塾大学医学部医化学教室/末松 誠 教授
6)慶應義塾大学医学部医化学教室/末松 誠 教授- ガス分子の生体制御機構の解明と医学応用の研究。(当プロジェクトの研究実施拠点。)

本グル-プは、ガス分子の標的因子およびその応答機構の分子メカニズムを系統的に解析するために、 1.ナノビーズを用いたガス標的分子の網羅的探索、2.メタボローム解析技術によるガス分子を介した代謝システム制御機構の解明、を行う。さらに、3.金、銀などの金属微粒子配列技術によるガス分子検出基盤技術の開発を行う。
1.ナノビーズを用いたガス標的分子の系統的探索本研究グループは、CO, NO, O2などのガス分子に対する新規の応答性因子の系統的探索をケミカルバイオロジーの手法により実施し、これらの情報を指標として新たな生体制御機構を分子レベルで解析し、ガス分子を介した未知の生理機能の解明を行うことを目的としている。具体的には、我々が開発を行ってきた独自のアフィニティ精製技術 (Kabe Y., Handa H., et al, [Chemical Biology/Chemical Genetics] CMC press)を駆使して、ヘム、鉄―硫黄クラスター、フラビンなどのガス分子応答性の補欠分子族をリガンドとして、これに特異的に結合するタンパク質の探索を行う。
2. メタボローム解析技術によるガス分子を介した代謝システム制御機構の解明種々の病態モデルや分化モデル、遺伝子改変動物等を用い、代謝物質測定技術を駆使することで、新規のガス分子応答性代謝経路を探索し、その結果、ガス分子がどのように細胞機能に変化を及ぼすかを生化学的、分子生物学的手法でその機構を明らかにすることを目的とする。我々は最近、メタボローム解析の結果からCOがtranssulfuration pathwayの抑制作用があることに着目し、当該代謝系の律速酵素にあたるヘム含有タンパク質cystathionineβ-synthase (CBS)がCOにより阻害され、NOでは阻害されないCO特異的な受容体のひとつであることを見出した(Shintani, et al. Hepatology 2009)。
3. 金、銀などの金属微粒子配列技術による、ガス分子検出基盤技術の開発と応用「バイオイメージングコアグループ」と連携して、顕微質量分析技術やNADPHやFADなど還元当量の自家蛍光を利用した細胞内レドックス動態のイメージング技術、ガス分子感受性プローブの設計を通じ、時空間依存的に変動する細胞内の代謝解析ツールを開発する。また、シリコン基板上に金あるいは銀のナノ粒子を蒸着、形成させることによって、組織に一定時間密着させて金属質量の増加をTOF-SIMSを用いて2次元にマッピングしたり、相互作用をリアルタイムにラマン分光技術で検出し、バイオイメージング用ツールに応用するための要素技術を創出する。

| 本グル-プは、ガス分子が生体内で感知・受容されることにより惹起される種々の生体分子の構造修飾・機能変化をin situで可視化するための基盤を構築し、生理的に意味のあるガス分子依存性代謝制御ポイントの探索を目指す。具体的には、1.多機能多光子生体顕微鏡装置、2.顕微質量分析装置、3.金属微粒子配列技術を活用した生細胞・組織におけるガス分子イメージング技術、4.ガス感受性バイオプローブ、の開発を行いガス分子の生体レベルでの動態について解析をする。 |
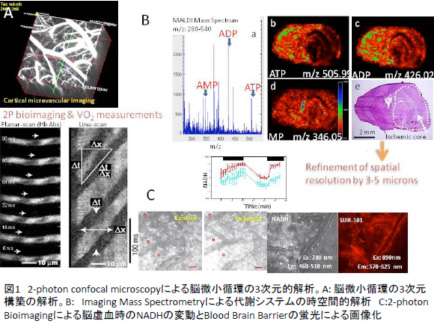 |
| 1.多機能多光子生体顕微鏡装置を用いた脳実質微小循環代謝動態のリアルタイム解析(図1A,C) 多機能多光子生体顕微鏡装置は、これまで不可能であった脳実質深部の微小循環動態や代謝動態をin vivoでリアルタイム-高時間分解能で捉えるために必須の複数のパラメターを同時計測する世界で初めての設計・仕様を有している。神経細胞・アストロサイト・微小血管から構成されるneurovascular unitにおけるガスメディエータを介した代謝血流連関の調節機構の解明、低酸素血症における血管拡張機序の解明などをこの装置を駆使することにより解明する。メディカルアプリケーションコアとの連携により、特定の細胞を蛍光蛋白標識した動物、あるいはガス感受性バイオイメージングプローブを導入したマウスなどを用いて、部位特異的なガス分子の生理作用の実体を解明する。 2.顕微質量分析イメージングを用いた局所におけるガス生成動態の解析(図1B) 顕微質量分析イメージング(MSI)は、組織や細胞を破壊して代謝物を計測する従来の網羅的代謝解析技術の弱点を克服する画期的な新技術であり、生体試料を直接、空間情報を保持したまま質量分析し、生体分子として固有な値である質量から分子種を同定し、生体内における位置情報を可視化することを可能にする。この方法では現在マクロ的なレベルでの解析:脳虚血部位と健常部との代謝物プロファイリングの違いを検出することが我々の予備実験で明らかになっているが、現存するMSIの空間分解能は数百―数十ミクロンであり、細胞サイズレベルあるいはそれ以下のイメージング技術は存在しない。Neurovascular unitやがんのmicrometastasisなどの局所におけるガス生成動態の変動とそれに伴う代謝システムの動態を解析するためには、空間分解能をさらに向上させる必要があり、本プロジェクトでそれを実現し、細胞レベルでのガス分子の拡散、受容、分解の挙動解析を試みる。 3.金属微粒子配列技術を活用した生細胞・組織における含硫ガス分子イメージング技術の開発と応用ケミカルバオロジーグループ3.参照 4.ガス感受性イメージングプローブの創出と応用 細胞内でガス分子が配位して機能制御をもたらす金属複合体を有する個々のタンパク質つまりガス分子の標的となる酵素の機能変化を利用したバイオイメージングツールの開発を行い、よいツールに関してはマウスへの導入を行ってin vivoでのガス分子の生理作用解明に活用する。 |
|

| ガスバイオロジーの研究成果を医学・創薬研究に展開するためには、1.ヒトにフィードバック可能な薬理薬効評価系の構築、2.ガス分子の運搬・受容・分解に直接および間接的に作用して病態を制御できる化合物の探索、が不可欠である。本プロジェクトでは、従来の実験動物を用いた評価系に加え、ヒト由来の細胞を体内に組織的に再現したhumanized animalを活用する一方、ガス分子医薬の開発を下記の1.2.3.の三つのカテゴリーに分類し、戦略的に目的を達成する。 1.ヒトにフィードバック可能な動物実験プラットフォームの開発 NO, CO, H2Sなどは反応性、可燃性などの性質から遊離ガスとして直接医薬に利用しにくい性質を有する。これらを利用するためには生体内移行を律速する技術開発が不可欠である。酸素は最も普遍的に医療に利用されているが、再酸素化障害などでは依然として問題があることは周知の事実である。本プロジェクトでは、細胞・臓器機能を制御するガス分子の生成や代謝を調節する薬剤を「ガス分子医薬」と位置付けて、(1)(2)で得られた基盤知見をもとに病態制御を可能にする医薬の創出を目指す。現時点では、ヒト由来腫瘍移植モデル(Hu-NOG、図2)、虚血性および炎症性臓器障害(脳、肝臓、消化管)、メタボリックシンドローム(HIF ノックアウトマウス)において特定のガスメディエーターを介した細胞応答の関与が示唆されている。 | |
| 特にガンにおける腫瘤形成、細胞増殖と低酸素環境の関係についてはERATO-ICORPとして米国Johns Hopkins大学Gregg Semenza教授との国際共同研究を推進する。通常、細胞が低酸素、細胞内のNOやCO等の濃度変化などのストレスに曝されると、ミトコンドリアの活性が抑制され、嫌気的にATPを得るため解糖系が亢進することが知られている。最近Fukudaらは低酸素時にHIF-1αがmyc、PGC1?の活性制御を介してミトコンドリアの生合成を負に制御していることを見出し | 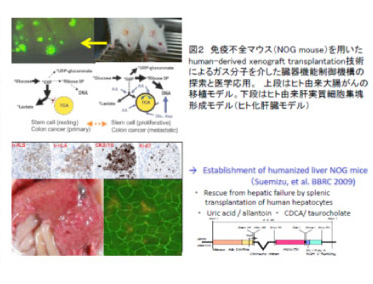 |
| (Fukuda R., Semenza, G., et al. Cell 2007)、低酸素応答時の代謝適応の一端を明らかにした。ICORPでは、酸素利用が限定されたり、ガス分子の濃度制御が極めて重要な細胞・組織が外界の酸素環境を感知しどのように自身の代謝を適応させていくかの分子メカニズムを解明する。 2.ガス分子医薬の開発 (a)ガスキャリア型またはプロドラッグ型医薬の開発 体内でガス分子を可逆的に結合し、必要な部位でガスを放出または捕捉するキャリア型またはプロドラッグ型医薬を開発する。具体的には、人工酸素運搬体などはこれに該当する。NOのキャリアとなるチオール化合物、NOを金属錯体に捕捉し、水溶液中でこれを放出して効果を発揮するもの。COは、水溶性ルテニウム錯体から構成されるドナー化合物が開発され一部臨床への応用が検討とされている。H2Sに関しては、NaHSがドナー化合物として知られているが、医薬としての活用はされていない。自然界に存在する低分子の非タンパク性-SH化合物としては、リポ酸やアスパラガス酸などが知られている。これらの類縁化合物が体内で代謝され、NOやH2Sのキャリアないしはドナーとしての機能を持つかどうかを実験的に明らかにし、有力な化合物の探索を行う。 (b)ガス生成代謝経路を制御する部位特異的ガス調節医薬 CO2はもっとも強力な脳血管拡張物質である。アミノ酸やモノカルボン酸などのエネルギー基質は酸化されて最終的にCO2の生成に繋がるため、脳血流の調節が局所の基質の「燃焼状態」をモニタリングしながら行われている可能性がある。その意味でCO2の受容体を探索することは代謝システムのfeedback regulationの標的を解明し、CO2自身あるいは代謝されてCO2となる低分子化合物を薬として利用する事が可能と考えられる。これはH2Sの場合も同じである。我々の未発表データではMethionineをH2Sに代謝できないcystathionineβ-lyase (CSE)のノックアウトマウスを作出して解析すると、methionineは他経路で分解し、毒性の高いCH3-SHが生成し、多数のたんぱく質が修飾を受けて筋肉を中心とした病変形成が惹起される。またH2Sのもうひとつの生成酵素であるcystathionineβ-synthase (CBS)のノックアウトマウスでは、脳の低酸素性血管拡張反応の欠損やGSH/GSSG比の低下が起こる。Methionineはhomocysteineを経てこれら2つの酵素系で代謝されて最終的に含硫アミノ酸代謝の終末ガス生成物であるH2SやSOxとなる。H2Sを生成するこれら二つの酵素のノックアウトマウスは、脳、肝臓、消化管、骨格筋などに病変が形成されることから、H2Sの細胞保護作用が示唆されているが、酵素反応の下流で生成される当該ガス分子の生理作用が欠損するためなのか、上流のmethionine代謝の異常によるものなのかは解明されていない。本プロジェクトでは、両酵素のノックアウトマウスを用いて、この疑問を解決するとともに、H2Sのドナー化合物としての含硫アミノ酸およびその近縁化合物の医薬としての応用の可能性を検討する。 (c) ガス分子の標的分子に結合してその機能を制御する「ガスシグナル干渉型医薬」本プロジェクトで研究対象とするガス分子の多くは病態修飾に関わることが現象論的に報告されていながら、その受容体の全貌が明らかにされていないものが多い。Nanobeadsを用いた受容体探索を行うことにより、すでに多くの「予想外に探索された重要な病態制御因子候補」が数多く同定されている。興味深いことに古くから臨床で用いられている生薬成分で、作用機序が解明されていない化合物の受容体探索を同じnanobeadsを用いて行うと、ガス分子の標的分子と重なる例が少なくないことがプロジェクトの準備段階で明らかになった。このように臨床効果が明らかで作用機序が従来の分子生物学的手法ではなかなか明らかにできなかった化合物が、ガス分子による病的な情報伝達を干渉することによって病態制御に貢献していた可能性をプロジェクトで検証し、新しい創薬パラダイムを構築したい。 |
|