多能性幹細胞を用いてマウスの体内でラットの膵臓を作製することに成功
研究の背景と経緯
臓器不全症の治療には現在、主に人工臓器や臓器移植が用いられています。例えば慢性腎不全の場合、約30万人もの人が人工透析を受けています(社団法人 日本透析医学会 2009年データ)。しかし、その治療費が年間1兆円を超え保険財政をひっ迫させているばかりでなく、何よりもこれらの患者は多くの合併症に苦しんでいます。一方で腎移植は、より有効な治療と考えられますが、社団法人 日本臓器移植ネットワークのデータによると2010年8月時点で移植待機者は約12,000人にのぼり、国外で移植を受けるといういわゆる渡航移植も問題となっています。慢性腎不全の原因の第1位は糖尿病性腎症であり、糖尿病の増加に伴って慢性腎不全患者も増加の一途をたどっています。このような背景の中、移植可能な臓器を患者自身の細胞から作ることは再生医療の重要な目標の1つとなっています。そのための細胞として期待されているのが生体内の全ての細胞に分化が可能な多能性幹細胞です。
多能性幹細胞である胚性幹細胞(Embryonic Stem cell:ES細胞)注3)がヒト受精卵から樹立されて以来、臨床応用を目指した多くの研究が進められてきました。特に近年、誘導型多能性幹細胞(induced Pluripotent Stem cell:iPS細胞)注4)技術の開発により、分化が進んだ体細胞をES細胞とほぼ同等の能力を持つ多能性幹細胞に簡便かつ再現性よく転換できることが可能になりました。これにより“自分の多能性幹細胞”から生体外で望みの細胞を作ることへの道が開け、糖尿病やパーキンソン病などのさまざまな疾患の治療に応用されようとしています。 しかし臓器を作るためには、その三次元的な構造を生体外で再現しなければならず、困難を極めます。そこで本研究では「胚盤胞補完法(Blastocyst complementation)」の技術に注目しました。胚盤胞補完法とは、特定の細胞を作る能力を欠損しているマウスの胚盤胞に正常なマウス由来の多能性幹細胞を注入しキメラ注5)が成立すると、欠損した細胞が完全に多能性幹細胞由来のものに置き換えられるというもので、今から15年ほど前にリンパ球を欠損したマウスを用いてその原理が報告されています。今回、この原理を応用し、遺伝的に特定の臓器を欠損するマウスの胚盤胞に多能性幹細胞を注入することで生体内で多能性幹細胞由来の臓器が作れないかと考えて研究を進めました。
研究の内容

図1 本研究成果の概略図
(1)胚盤胞補完法を利用した多能性幹細胞からの臓器作出(図1A)
本研究ではまず、胚盤胞補完法により臓器が作れるかを明らかにするため、マウスの多能性幹細胞と、膵臓ができないように遺伝子操作したPdx1ノックアウト(KO)マウス注6)を用い、多能性幹細胞由来の膵臓が作れるかを試みました。Pdx1 KOマウスの胚盤胞に緑色蛍光たんぱく質EGFPで標識した多能性幹細胞(ES細胞もしくはiPS細胞)を注入し、仮親の子宮へ移植した後、新生児を解析しました。その結果、多能性幹細胞の寄与が認められたPdx1 KOマウスの膵臓は、一様にEGFP蛍光を示しました(図2)。EGFP陽性細胞の分布と、膵臓の機能を示す生体因子との相関を組織学的に確認したところ、膵臓を構成する外分泌組織、内分泌組織、膵管のそれぞれがすべてEGFP陽性の多能性幹細胞由来の細胞から構成されていました。そのような膵臓を持ったマウスは高血糖などの症状を示すことなく成体まで発育し、正常な耐糖能も獲得していることから、多能性幹細胞由来の膵臓が生体内で正常に機能していることが分かりました。また、iPS細胞由来の膵臓から単離した膵島を糖尿病マウスに移植して血糖を正常化させることにも成功し、膵島移植のドナーとしても利用できることを示しました。このことから、胚盤胞補完法により多能性幹細胞由来の機能的な臓器を作り出せることが分かりました。
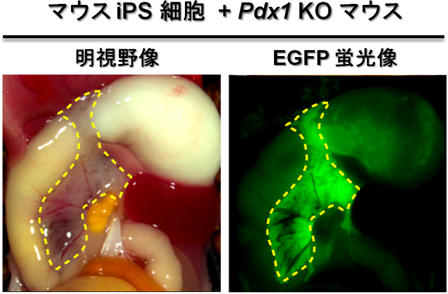
図2 Pdx1 KOマウス体内に作られたマウスiPS細胞由来の膵臓(点線内)
(2)マウスおよびラット多能性幹細胞を用いた異種動物間キメラ注7)の成立(図1B)
次に異種動物間におけるキメラ形成能を確認するため、多能性幹細胞(ES細胞もしくはiPS細胞)を用いたマウス-ラット間の異種動物間キメラ作製を試みました。EGFP標識したマウス多能性幹細胞をラットの胚盤胞に、逆にEGFP標識したラット多能性幹細胞をマウスの胚盤胞に注入したところ、マウスおよびラットの多能性幹細胞は互いの胚発生に寄与し、出生後も生存可能な異種動物間キメラの作製に成功しました(図3)。EGFP蛍光を指標に異種の多能性幹細胞由来の細胞の分布を確認したところ、ほぼ全ての組織においてEGFP陽性細胞の存在が確認されたことから、多能性幹細胞を用いることで世界初のマウス-ラット異種動物間キメラを双方向から作製することに成功し、注入された多能性幹細胞は異種動物の環境においても正常に胚発生を経て全身の機能的な細胞に分化できることが分かりました。

図3 マウス-ラット異種間動物キメラ
右:野生型ラット
中:ラットiPS細胞を野生型のマウスの胚盤胞に注入してできたキメラマウス
左:野生型マウス
(3)異種間胚盤胞補完法を用いて、マウス体内にラットの膵臓を作る(図1C)
最後に、上記(1)と(2)の知見を組み合わせてラットiPS細胞をPdx1 KOマウスの胚盤胞に注入することで、異種動物間胚盤胞補完法を介してラットの膵臓をマウス体内に作り出そうと試みました。その結果、Pdx1 KOマウス体内で一様にEGFP蛍光を示すラットiPS細胞由来の膵臓を作出することに成功しました(図4a)。それらは組織学的な解析においても一様にEGFP蛍光を示す細胞で構成されており、膵臓の機能を示す生体因子の発現も認められました。また、このラットiPS細胞由来の膵臓を持ったPdx1 KOマウスは成体にも発育し(図4b)、正常な耐糖能を獲得していました。
以上の結果から、マウスの体内にラットの多能性幹細胞由来の膵臓を作ることで、異種動物間の胚盤胞補完法により異種個体内に多能性幹細胞由来の臓器を作るという原理を証明しました。
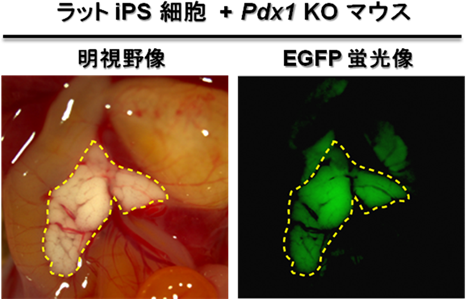

図4 (a)Pdx1 KOマウス体内に作られたラットiPS細胞由来の膵臓(点線内)と、
(b)ラットiPS細胞由来の膵臓を持つPdx1 KOマウス個体
今後の展開
本研究成果から、多能性幹細胞と胚盤胞のように、用いる細胞と胚が適切なタイミングと場所で同調すれば、例え異種動物の環境であっても、発生過程を利用して外から入れた細胞由来の臓器を作り出せることが分かりました。この原理を応用すれば、ヒトの臓器がどのように形成されるのか、そのメカニズムを異種動物の体内で解析することが可能になります。さらに患者由来の多能性幹細胞や、そこから生体外で分化させた細胞や組織を大型動物の個体の中に適切なタイミングと場所に移植することで、自身の臓器を作ることも可能になるかもしれません。このように本研究で証明した原理は、臓器再生という再生医療の最終的な目的を実現するための最初のステップとなりうるものと期待されます。