ポイント
- あらゆる生命現象はたんぱく質の相互作用で制御されており、その研究には鋭敏な検出技術が不可欠。
- ホタル発光酵素の2段階反応を利用して、たんぱく質同士の相互作用を高感度に検出する技術を開発し、複数のたんぱく質間相互作用の検出に成功。
- 簡便、迅速かつ高性能な臨床診断、薬物探索が可能に。
JST 先端計測分析技術・機器開発プログラムの一環として、東京工業大学 資源化学研究所の上田 宏 教授(前 東京大学 大学院工学系研究科 准教授)らの開発チームは、ホタル発光酵素の反応機構を利用して、たんぱく質同士の相互作用を迅速、簡便、高感度に検出できる新技術の開発に成功しました。
さまざまな生命現象は、多くのたんぱく質が互いに作用し合って制御されており、ヒトの細胞内には、15~30万種類ものたんぱく質間相互作用が存在するといわれています。生命現象の理解を深め、さらに創薬など他分野に応用するためには、たんぱく質間の相互作用の検出技術が不可欠です。従来は、1つの発光たんぱく質を分断し、個々のパーツと相互作用を調べたいたんぱく質を融合します。目的の相互作用が起こると、発光たんぱく質の個々のパーツが再構築されて発光し、その光を検出するなどしていました。しかし、目的の相互作用が起こったとしても、パーツ同士が自発的に上手く組み合わさって本来の構造と機能を再構築するとは限らないため、さまざまな試行錯誤が必要でした。
開発チームは今回、ホタル発光酵素の反応機構が2つの「半反応」から成り立っていることを利用して、迅速で高感度にたんぱく質同士の相互作用を検出する技術の開発に成功しました。半反応のみを行う2つの変異体注1)酵素をそれぞれ作成して、お互いが十分近づくと、はじめの半反応で生まれた反応中間体注2)がもう片方に受け渡されて2つめの半反応が起き、発光します。つまり、2つのたんぱく質を各変異体に個別に融合して発現させ、発光が見られれば、これらが相互作用することがわかります。この場合、発光に関与する酵素を再構築する必要がないため、迅速、高感度で安定した測定が可能です。
この成果は、細胞内外を問わず、高感度に1秒以内で各種のたんぱく質間相互作用を測定可能とするものです。将来的には、基礎研究の発展のみならず、臨床診断の高性能化や抗がん剤などの薬物探索の迅速化にも大きく貢献することが期待されます。
本成果は、大室 有紀 日本学術振興会 特別研究員、和田 猛 東京理科大学 薬学部 教授らとの共同開発によって得られ、2013年8月1日(米国時間)発行の米国科学雑誌「Analytical Chemistry」に掲載されます。
本開発成果は、以下の事業・開発課題によって得られました。
| 事 業 名 |
研究成果展開事業(先端計測分析技術・機器開発プログラム)要素技術タイプ |
| 開発課題名 |
「迅速高感度な新規蛋白質相互作用検出系の開発」 |
| チームリーダー |
上田 宏(東京工業大学 資源化学研究所 教授) |
| 開発期間 |
平成21~24年度 |
| 担当開発総括 |
伏見 譲(埼玉大学 研究機構 特任教授) |
JSTはこのプログラムの要素技術タイプで、計測分析機器の性能を飛躍的に向上させることが期待される新規性のある独創的な要素技術の開発を目指しています。
<開発の背景と経緯>
ヒトゲノムとそこに指定されるたんぱく質の配列が明らかになってから、約10年が経過しました。しかし、生命の神秘はいまだに解き明かされておらず、さまざまな病気の原因も不明なままです。その一因として、たんぱく質の機能、特にたんぱく質同士の相互作用について、理解が不十分なことが挙げられます。現在、ヒト細胞内には、15~30万種類のたんぱく質間相互作用が存在するといわれています。これらの時間的・空間的な変化やその制御機構の理解は、生命現象の解明に不可欠であるのみならず、疾患治療薬の開発などの応用研究開発を進める上でも極めて重要です。
従来から基礎研究や薬物探索の分野においては、相互作用を分析したい目的たんぱく質に、ほかの発光たんぱく質のパーツなどを融合して細胞に発現させ、相互作用の有無による発光強度の変化を検出する方法がとられてきました。しかしこの方法では、パーツのつなぎ方に試行錯誤が必要でした。そのほかにも、細胞内外でたんぱく質同士の相互作用を検出する技術は複数あります。しかし、分析したい相互作用のみを感度よく確実に検出するためには、測定の前処理や準備などに多くの試行錯誤が必要です。そのため従来法では、熟練した技士の手でも測定結果を得るまでに数時間から数日を要するため、迅速・簡便に目的の相互作用を分析できる新技術の開発が求められていました。
<開発の内容>
ホタルの発光酵素「ルシフェラーゼ」はホタルの生物発光の源となる酵素で、多くの人々によって、その反応機構と構造が解析されてきました。近年、ルシフェラーゼは1つの酵素であるにもかかわらず、その構造を変化させながら2つの半反応を行うことが明らかになりました。ルシフェラーゼは、N末側とC末側注3)の2つの領域(ドメイン)からなる酵素で、基質であるルシフェリンと反応して光を発します。その際、最初にN末側ドメインがルシフェリンを反応中間体に変化させます(1段階目の半反応)。次にC末側ドメインが140°回転してその中間体を受け取り、発光反応を行います(2段階目の半反応)(図1)。
開発チームは以前より、ルシフェラーゼのN末側ドメインを用いて反応中間体の定量法を開発し、さまざまなルシフェラーゼ変異体の反応解析を行っていました。その際、2段階目の半反応(発光反応)のみが遅い変異体(H245D)があることを見いだしました。この知見から、1つの半反応のみが効率よく行われ、別の半反応が行われないような変異体同士を相補的に組み合わせれば、反応中間体の受け渡しが起こり、各変異体単独では見られない発光反応を検出できるのではないか、と考えました。つまり、それらの変異体と分析対象のたんぱく質をそれぞれ融合して発現し、基質を加えて発光が見られる場合、変異体同士が十分に近づいてルシフェラーゼ本来の機能が再構成されたことを示すので、分析対象のたんぱく質同士が相互作用することの証明となると考えたのです。
この仮説を検証するため、開発チームはまず、相互作用たんぱく質ペアの例として、FKBP12とFRBという2種類のたんぱく質を用いました。これらは、ある分子(ラパマイシン)が存在する場合のみ、相互作用することが知られています。そこで、FKBP12に、中間体を効率よく生成するがそれ自身はほとんど発光しないルシフェラーゼ変異体(中間体ドナー)を、FRBには微量の中間体で効率よく発光するがルシフェリンとは弱くしか発光しないルシフェラーゼ変異体(中間体アクセプター)を遺伝子的に結合させ、大腸菌で発現させました(図2)。
「FKBP12に結合した中間体ドナー」と「FRBに結合した中間体アクセプター」の混合溶液に、基質であるルシフェリンを加えたところ、弱い発光しか見られませんでした。一方、ルシフェリンとともにFKBP12とFRBの相互作用を促すラパマイシンを加えた場合は、基質添加後1秒以内に発光強度が濃度依存的に顕著に(最大25倍以上)上昇し、その検出感度も十分高いことが明らかとなりました(図3)。さらに相互作用抑制効果のある抗生物質FK506を加えた場合には、発光は顕著に弱まったことから、この発光上昇は相互作用するたんぱく質ペアでのみ起きることがわかります。また、ほぼ同じたんぱく質を培養細胞(Cos-7あるいは293T細胞)に発現させた場合にも同様のラパマイシン依存的発光が見られました。この結果は、今回のホタル発光中間体に基づく相互作用検出法(Firefly luminescent intermediate-based Protein Interaction Assay、FlimPIA)が細胞内外で利用可能なことを証明するものです。
FlimPIA法の有用性を実証するため、細胞のがん化に関与する2つのたんぱく質(p53とmdm2)の相互作用についても測定しました。その結果、試験管内で両者の相互作用に依存的な発光増大を観察することができました。さらに、既知の相互作用阻害剤(Nutlin-3)の添加によって、その発光が抑制されました。この結果は、本反応の特異性を示すのみならず、この技術が新たな薬物探索にも応用できる可能性を示すものです。FlimPIA法は、従来の酵素を2つの断片に物理的に分割してそれらの再構成を検出する相互作用検出法(Protein-fragment Complementation Assay、PCA)に比べ、精製したプローブの発光強度と安定性において数倍以上優れており、試験管内での簡便迅速な検出系として幅広い利用が期待されます。
<今後の展開>
開発チームは、ホタル発光酵素の反応分割と機能的再構成という全く新しい原理に基づいて、たんぱく質間の相互作用を検出する新技術、FlimPIA法の開発に、世界で初めて成功しました。本技術は、細胞内外を問わずに活用できる高い有用性を示すのみならず、従来法よりも迅速に感度よくたんぱく質間相互作用の検出を可能とするものです。今後も、特に中間体アクセプターを改良することによって、バックグラウンドの発光値を下げ、検出感度をさらに向上させることが期待できます。
将来的に、FlimPIA法によるたんぱく質間の相互作用検出は、より感度が高く効率の良い薬剤スクリーニングへの応用が期待されるとともに、脂質代謝酵素など類縁酵素の活性制御などへの応用も考えられます。
<付記>
本開発成果の一部は、上田教授が東京大学 大学院工学系研究科、和田教授が東京大学 大学院新領域創成科学研究科の在籍中に得られたものです。
なお本研究開発は、JST 先端計測分析技術・機器開発プログラム(要素技術タイプ)、科学研究費補助金(基盤B)、リバネス研究費マイクロテックニチオン賞の支援を受けて実施しました。
<参考図>
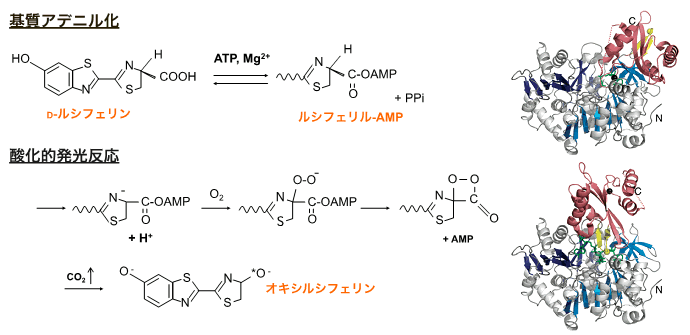
図1 ホタルルシフェラーゼの触媒する2つの半反応と、
それぞれの反応時の酵素の立体構造モデル
まずN末側ドメインがエネルギー物質ATP注4)を用いて、ルシフェリンをアデニル化注5)する。次にC末側ドメインが140°回転してアデニル化したルシフェリンを受け取り、酸化的発光反応注6)を行う。
C末ドメイン(赤)が140°回転することにより、それぞれの活性部位を形成する。各反応において鍵となる残基(Lys529,Lys443/His245)に変異を導入した。
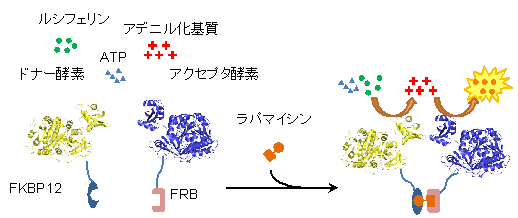
図2 新規検出法FlimPIAによる相互作用検出の模式図
ラパマイシン依存的なFKBP12-FRB相互作用の検出の例を示す。FKBP12に結合した中間体ドナーが産生するアデニル化基質は酵素の近くで高濃度に存在するため、FRBに結合した中間体アクセプターが近接した場合にその発光強度がより高まる。
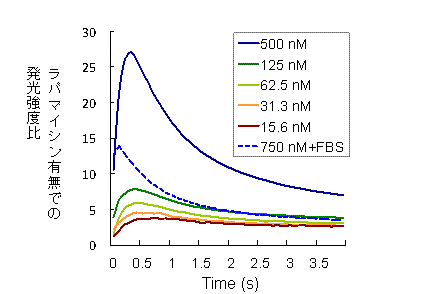
図3 FlimPIAの測定結果
「FKBP12に結合した中間体ドナー」と「FRBに結合した中間体アクセプター」が同濃度で混合された溶液中において、同じく濃度の等しいラパマイシンの有無での発光強度比の時間変化を示す。基質添加後1秒以内に最大のシグナル/バックグラウンド比が得られた。750nM+FBSは40%ウシ血清存在下での測定結果。
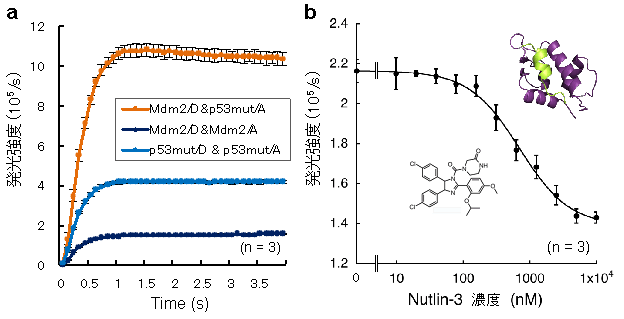
図4 がん抑制遺伝子由来のたんぱく質p53と、
それを制御するたんぱく質Mdm2の相互作用検出結果
a)Mdm2あるいはp53由来ペプチドを中間体ドナー(D)あるいは中間体アクセプター(A)と結合させた場合の発光強度の時間変化。Mdm2とp53由来ペプチドのペアで有意に高い発光強度が得られた。b)Mdm2-p53相互作用阻害剤Nutlin-3(図)によるピーク発光強度の変化。aとはやや条件が異なる。Mdm2(紫)-p53ペプチド(黄緑)複合体の構造モデルとともに示す。
<用語解説>
- 注1)変異体
- 一般にたんぱく質はアミノ酸残基が数百個、一定の配列で結合してできています。そのうちのある特定のアミノ酸残基が別のアミノ酸に変化したたんぱく質を変異体といい、天然型のたんぱく質を野生型といいます。かつては自然界で偶然に生じる場合がほとんどでしたが、最近では遺伝子工学的方法などで変異を導入し、酵素などのたんぱく質の性質を人為的に変化させることが多くなってきました。
- 注2) 反応中間体
- 酵素が複数の化学反応を触媒する場合、最終的な生成物以外に途中で生成される物質のこと。
- 注3) N末側、C末側
- アミノ酸が直鎖状に連なった、たんぱく質の2つの末端のどちらかに近い方という意味。N末はアミノ末端、C末はカルボキシ末端の略。
- 注4) ATP
- アデノシン3リン酸。分子内に高エネルギーなホスホジエステル結合を2つ持つため、生命が頻繁に用いる代表的なエネルギー物質。
- 注5) アデニル化
- 基質に高エネルギーなアデノシン1リン酸(AMP)を付加する反応。ルシフェラーゼの触媒する一連の反応の中で最も困難で、かつカギとなる反応といわれています。
- 注6) 酸化的発光反応化
- アデニル化ルシフェリンに分子状酸素を添加し、不安定なジオキセタン構造が脱炭酸した結果生成される、オキシルシフェリンからの発光を伴う一連の反応。
<論文名>
“A Protein-Protein Interaction Assay Based on the Functional Complementation of Mutant Firefly Luciferases”
(変異体ホタルルシフェラーゼの機能的相補に基づくたんぱく質間相互作用検出系)
doi: 10.1021/ac4016825
<お問い合わせ先>
<開発内容に関すること>
上田 宏(ウエダ ヒロシ)
東京工業大学 資源化学研究所 教授
〒226-8503 神奈川県横浜市緑区長津田町4259 R1-18
Tel:045-924-5248 Fax:045-924-5248
E-mail:
<JSTの事業に関すること>
久保 亮(クボ アキラ)、菅原 理絵(スガワラ マサエ)
科学技術振興機構 産学基礎基盤推進部 先端計測室
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3529
E-mail:
ホームページURL:https://www.jst.go.jp/sentan/