ナノゲルテクトニクス工学
ナノゲル架橋マイクロスフェアの開発と機能
| マイクロメートルサイズの粒子は、インジェクタブルで薬物の長期徐放などが実現できる材料として注目されています。そこで、我々はエマルション中でナノゲルの架橋反応を行うことで、ナノゲル架橋ゲル粒子(Nanogel-cross-linked microsphere, NanoClikマイクロスフェア)を構築する手法を開発し、そのDDS機能について検討しました。Stimulated emission depletion(STED)顕微鏡観察などの方法によって、調製されたNanoClikマイクロスフェアは、直径約10 μmの球形のゲル粒子であり、その内部にはナノゲル構造が存在するということが明らかとなりました。また薬物を封入し、そのリリース挙動を解析すると、NanoClikマイクロスフェアでは“薬物を封入したナノゲル”がリリースされるというユニークな特徴をもつことも分かりました。また体内(in vivo)におけるNanoClikマイクロスフェア分解後の薬物の動態は、細胞への取込みやリンパ節へのデリバリーという、ナノゲル独自の特性を示しました。さらにマイクロメートル領域での粒子径のコントロールや、多層構造をもつNanoClikマイクロスフェアの調製にも成功しています。このような特性を持つNanoClikマイクロスフェアは、インジェクタブルな薬物の長期徐放や、徐放速度の制御、多段階の徐放、ナノゲルの特性による体内分布の制御などが実現可能な、新しいDDSキャリアとして今後の応用が期待されます。 | 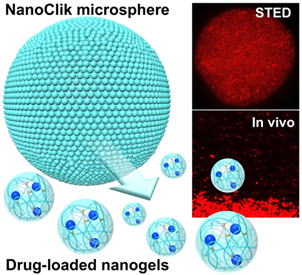 図1 ナノゲル架橋マイクロスフェア概念図 |
| 論文 Y. Tahara, S. Mukai, S. Sawada, Y. Sasaki, K. Akiyoshi, Nanocarrier-Integrated Microspheres: Nanogel Tectonic Engineering for Advanced Drug-Delivery Systems, Adv Mater 27 (2015) 5080-5088. |
多孔性ナノゲル架橋ハイブリッドゲルの開発とバイオ応用
| 近年、組織再生のための足場として、高分子ハイドロゲルと細胞増殖因子を複合化した材料の開発が進められています。しかしながら、ハイドロゲルの三次元ネットワーク構造は、細胞浸潤や血管新生などの組織再生プロセスを促進するために必要な空隙サイズより小さいため、細胞スケールの連通多孔質構造を有するハイドロゲルの開発が望まれています。一方、細胞増殖因子は組織再生プロセスを促進することから広く用いられていますが、非常に不安定な化合物であり、生体内では急速に失活・分解されてしまう問題があります。我々は、アクリロイル基置換コレステロール置換ナノゲル(CHPOA)と末端チオール化ポリエチレングリコール(PEGSH)からなるナノゲル架橋(NanoClik)ゲルに、凍結融解法により、直径数百マイクロメートルの連通多孔質構造を付与した多孔性NanoClikハイブリッドゲルを開発しました。興味深いことに、この多孔性NanoClikハイブリッドゲルの貯蔵弾性率がNanoClikハイブリッドゲルに比べ10倍上昇することがわかりました。また、多孔性NanoClikハイブリッドゲルがタンパク質、リポソームおよび細胞と容易に相互作用し複合化できることも明らかとしました。この機能により、フィブロネクチンと複合化した多孔性NanoClikハイブリッドゲル上でマウス繊維芽細胞を培養すると、ゲルの孔内に細胞が侵入し、接着、生育することが確認され、さらには多孔性NanoClikハイブリッドゲルをマウス皮下に埋入し、埋入1ヶ月後にゲルを含む組織をHE染色により評価したところ、マウス由来の細胞や血管がゲルの多孔質構造部に浸潤していることが明らかとなりました。 | 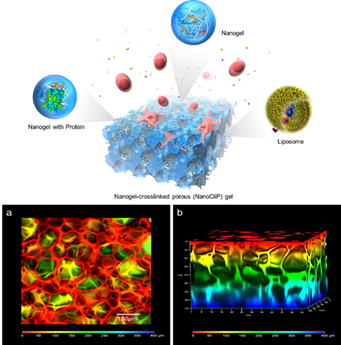 図2 多孔性NanoClikゲルの特徴 a, b) 2光子励起レーザー顕微鏡で観察した3次元立体構造。 |
| 論文 Y. Hashimoto, S. Mukai, S. Sawada, Y. Sasaki, K. Akiyoshi, Nanogel tectonic porous gel loading biologics, nanocarriers, and cells for advanced scaffold, Biomaterials 37 (2015) 107-115. |
酵素重合反応による新規糖鎖スターポリマーの合成とバイオ応用
| 直鎖のα(1,4)グルカンからなるアミロースは、水溶液中でらせん構造をとり、その内部に化合物を取り込む1次元ホスト分子として知られており、このような性質から機能性素子として古くから利用されています。 我々は、クリック反応とホスホリラーゼによる酵素重合反応を組み合わせて、アミロースが1,2,4,8本付加したスターポリマーを合成し、そのホスト分子の機能の拡張およびバイオ応用を試みました。 アミロース鎖の重合度は、酵素反応時間により制御が可能であり、8本鎖プライマーでは酵素反応により伸長したアミロース鎖間のヘリックス形成によりゲル化するという現象を見出しました。 酵素重合によって得たアミローススターポリマーは、種々の疎水性化合物を取り込み、さらには1,2,4,8本とアミロース鎖が増加するのに伴い、協同的に化合物を取り込むアロステリックなホスト分子として振る舞う事が明らかとなりました。また、カチオン化スターポリマーは、核酸シャペロン様の機能を有しており、ポリマー鎖数の増加により交換速度が増加することが確認されました。ミカエリス-メンテン式による解析から、交換速度の増加は、ポリマー鎖数の増加に伴う核酸との親和性の増大が要因である事を見出しました。 | 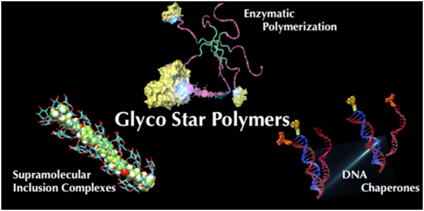 図3 (中央)酵素重合反応によるグライコスターポリマーの合成、(左)アミロースによる超分子複合体の形成、および(右)DNA鎖交換反応の模式図 |
| 論文 T. Nishimura, S. Mukai, S. Sawada, K. Akiyoshi, Glyco Star Polymers as Helical Multivalent Host and Biofunctional Nano-Platform, Acs Macro Lett 4 (2015) 367-371. |
|
カチオン性アミローススターポリマーによるsiRNAデリバリー
| siRNAなどの核酸医薬品は標的遺伝子への特異性が高いことから次世代バイオ医薬品として期待されています。siRNAは、安定性や細胞移行性の低さから、疾患の治療にはキャリアが必要不可欠です。我々は、酵素重合により合成したアミローススターポリマーにカチオン性基としてスペルミンを導入したポリマーを合成し、そのsiRNAキャリアとしての有用性を検討しました。糖鎖重合度60の8本鎖アミローススターポリマーに、スペルミンを導入したポリマーは、血管内皮細胞増殖因子(VEGF)を発現抑制するsiRNAと複合化し、約230nmの正電荷を有する粒子を形成しました。この複合体をRenca(マウス腎癌)細胞に導入し、mRNAの定量を行ったところ、有意な抑制が確認されました。その抑制効果は、1本鎖ポリマーに比べ高く、市販の遺伝子導入剤(Lipofectamine 2000)と同程度であることが明らかとなりました。 | 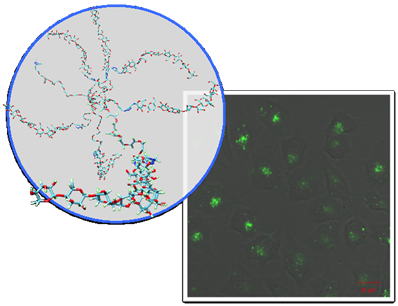 図4 グライコスターポリマーの模式図とグライコポリマーによりAlexa-488修飾siRNAを導入されたRenca細胞の共焦点顕微鏡像 |
| 論文 T. Nishimura, K. Umezaki, S.A. Mukai, S. Sawada, K. Akiyoshi, Amylose-Based Cationic Star Polymers for siRNA Delivery, Biomed Res Int 2015 (2015) 962941. |
