Home > 研究代表者・研究課題

| 胚細胞ヒストンによるリプログラミング機構 | |
| 造血幹細胞のエピジェネティクスとその制御法の創出 | |
| iPS細胞誘導の為の分子基盤の解明による安全性の確保 | |
| ヒト人工染色体を用いたiPS細胞の作製と遺伝子・再生医療 | |
| ヒトiPS細胞の分化能と腫瘍化傾向を反映するマーカー遺伝子群の探索 | |
| 人工癌幹細胞を用いた分化制御異常解析と癌創薬研究 | |
| 精子幹細胞のリプログラミング機構の解明と医学応用の可能性の検討 | |
| iPS細胞由来の樹状細胞とマクロファージを用いた医療技術の開発 | |
| 分化細胞に多能性を誘導する転写因子ネットワークの構造解析 | |
| 人工染色体を用いた新たな細胞リプログラミング技術開発 |
胚細胞ヒストンによるリプログラミング機構 (H25年度をもって終了)

卵子に多量に存在する胚細胞ヒストンが、初期胚の発生に関与する、いわゆる「maternal effect」(母性効果)因子であることを明らかに、かつし山中因子によるリプログラミングを促進することを明らかにした。 胚細胞ヒストンはオープンクロマチン構造を形成し、リプログラミング過程でX染色体に多く局在することを見いだした。この結果は、胚細胞ヒストンを用いたリプログラミング機構が核移植に似ていることを示唆しており、リプログラミングの新たなメカニズムの理解に繋がるものである。
造血幹細胞のエピジェネティクスとその制御法の創出 (H25年度をもって終了)

本研究では、組織幹細胞の自己複製能・多能性を規定するエピジェネティクスの理解を通して、iPS細胞から組織幹細胞を誘導するエピジェネティック制御法の分子基盤の確立をまず行った。そのうえで、iPS細胞を用いた再生医療の推進し資することを目指した。具体的には、造血幹細胞を規定する遺伝子発現の制御機構、特にクロマチン修飾を介した制御機構の解析を行うとともに、iPS細胞のエピジェネティックプログラムを造血幹細胞型へと効率良く書き換える基盤技術の開発を行った。
iPS細胞誘導の為の分子基盤の解明による安全性の確保 (H25年度をもって終了)

本研究プロジェクトでは、partial iPS細胞であるとか、iPS細胞誘導の効率を促進する因子の検索であるとか、様々な研究を行ってきたが、それらの中でc−Mycに関する研究に関してはオリジナリティーの高い研究成果を生み出すことができたと自負している。事実、ES細胞がグランドステートにある場合は、c-Myc因子非依存的にES細胞としての分化多能性、自己増殖性を維持することが可能であることを示すなど、c-Mycに関していくつかの新知見を見出し、発表することができた。
ヒト人工染色体を用いたiPS細胞の作製と遺伝子・再生医療 (H25年度をもって終了)

人工染色体ベクターの(1)ホストゲノムに組み込まれない(2)搭載出来る遺伝子サイズに制限がない(3)正確な遺伝子発現制御が可能であるという特徴を活用して、体細胞初期化、分化誘導モニター、疾患細胞の遺伝子治療及びiPS細胞から作製した治療用細胞の安全性確保を可能にする人工染色体ベクターを構築することができました。このうち、疾患モデルを用いたデュシャンヌ型筋ジストロフィー治療においては、遺伝性疾患に対するiPS細胞による細胞再生療法に人工染色体技術が有用であることを明らかにしました。
ヒトiPS細胞の分化能と腫瘍化傾向を反映するマーカー遺伝子群の探索 (H24年度をもって終了)

iPS 細胞の臨床応用に向けて、それを用いた細胞療法の有効性と安全性を予め示す必要があり、そのためのマーカーが必要とされています。本研究では、リンパ球由来iPS細胞を用いて、そのようなマーカーの探索を行ってきました。マウスのNKT細胞からiPS 細胞を誘導し、それらから多量のNKT細胞を試験管内で誘導し、それらを担がんマウスに移植することで抗腫瘍活性を発揮することを示しました。また、ヒトのメラノーマ抗原特異的T細胞についても、iPS細胞を経て機能的な抗原特異的T細胞を大量に誘導できることを示しました。このような、リンパ球由来iPS細胞を用いて、分化能や腫瘍化傾向と相関して発現が変化する遺伝子の探索を行ってきました。その結果、iPS細胞から他の系列への分化能とリンクするマーカー遺伝子群候補の抽出に成功しました。
人工癌幹細胞を用いた分化制御異常解析と癌創薬研究 (H25年度をもって終了)

マウス正常体細胞に特定の遺伝子操作を行うことで、自己複製能と分化能、腫瘍形成能を有する癌幹細胞(induced cancer stem cell: iCSC)が誘導でき、分化度および細胞外マトリクス相互作用を変えることで腫瘍形成能が抑制できましたそこで本研究は、各種iCSCを用いて分化度とニッチ機能を定量化できるアッセイ系を構築し、それを制御できる化合物や抗体などを取得することを目的として実施しました。その結果、癌幹細胞の治療抵抗性の中心的な分子機構を明確にすることができ、その機構を抑制するための薬剤を見出し、動物モデルを用いた非臨床試験で効果を確認し、実際の臨床試験まで進めることができました。
精子幹細胞のリプログラミング機構の解明と医学応用の可能性の検討 (H25年度をもって終了)

我々はp53欠損germline stem (GS) 細胞を用いて、生殖細胞腫瘍候補遺伝子に着目し多能性誘導能のスクリーニングを行った。その結果、Dmrt1が多能性誘導に関与することを見いだした。更にこの下流分子を検索した結果、Sox2が同定された。Sox2はGS細胞でmRNAは発現しているものの、タンパク質へ翻訳されていない分子である。そこで発現抑制を克服するために高力価のSox2の強制発現とp53の抑制を行ったところ、Oct4が誘導されるのみならず、mGS細胞が出現した。これらのことから、Dmrt1の発現抑制でSox2が過剰発現することがGS細胞の多能性獲得の基本メカニズムであるとの結論を得た。
iPS細胞由来の樹状細胞とマクロファージを用いた医療技術の開発 (H25年度をもって終了)

樹状細胞やマクロファージは、がんやアルツハイマー病に対する治療細胞として有用であると考えられますが、従来、これらを工業的スケールで生産する技術はありませんでした。私たちは、CREST研究において、ヒトのiPS細胞から増殖性を有するミエロイド系細胞を作製する方法を開発し、この細胞をiPS-MLと命名しました。iPS-ML技術を基盤とすることにより、任意の遺伝的背景を有する樹状細胞とマクロファージを大量生産することが世界で初めて可能となりました。ヒトの腫瘍細胞を免疫不全マウスに移植したゼノグラフトモデルにおいてiPS-MLを用いた治療の有効性が観察され、現在、この細胞治療の臨床試験を計画しています。
分化細胞に多能性を誘導する転写因子ネットワークの構造解析 (H25年度をもって終了)

なぜ、わずかな数の転写因子を強制的に発現させるだけで体細胞に多能性が賦与されるのかは、大きな謎となっています。本研究では、多能性を維持するシグナル入力がどのように転写因子ネットワークに入力して機能するのか、さらに転写因子ネットワークにおいて個々の転写因子の機能がどのように規定されるのかについて、基本的なコンセプトを明らかにしました 。
人工染色体を用いた新たな細胞リプログラミング技術開発 (H25年度をもって終了)

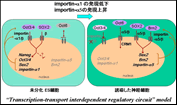
本研究では核輸送因子が転写因子の核内移行を抑制することにより未分化を維持する働きを持つという新しいES細胞の未分化維持機構や、Oct4リプログラミング因子の核内滞在時間がリプログラミングに果たす重要性などを明らかにすることが出来ました。これらの得られた知見は、核-細胞質間輸送制御が細胞リプログラミングに深く関連することを実証するものであります。さらに、脱落制御可能な人工染色体ベクターの開発に成功し、iPS誘導4因子を挿入した人工染色体をMEFに導入して、4因子の発現を確認しました。これは、新たなベクターとして期待できます。