核酸医薬用DDSナノ粒子RION
~高い腫瘍集積性を特長とするナノキャリアフリー核酸医薬用DDSの設計~
宮本 寛子(愛知工業大学)
発明のポイント
- ・薬効を示す核酸のセンス鎖を化学修飾することで核酸自身をナノ粒子化
- ・核酸自体をナノ粒子化することによりナノキャリアフリーを実現したDDS設計

高い腫瘍集積性を有するDDS技術
(有効成分の薬効向上へ貢献!)
【参考】 既存のナノキャリアの短所とナノ粒子RIONの特長
|
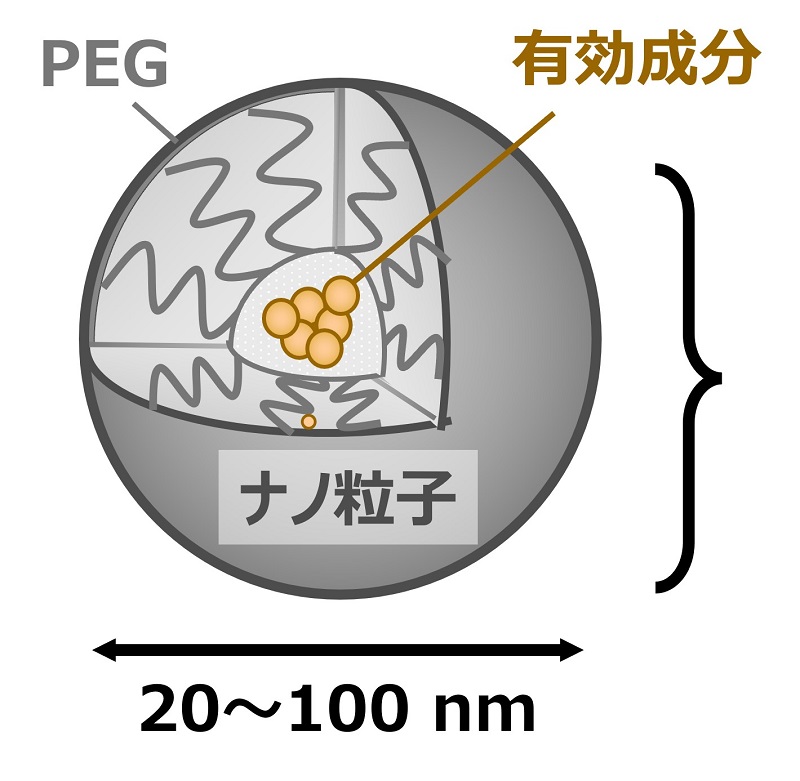 |

- ◎ナノ粒子RION
- ・腫瘍集積性が高い(肝臓への集積は不検出)
- ・血中安定性が高い(>2時間)
- ・有効成分の担持率が高い(核酸のみで構成)
- ・核酸自体をナノ粒子化(担体が存在しない)
発明の概要
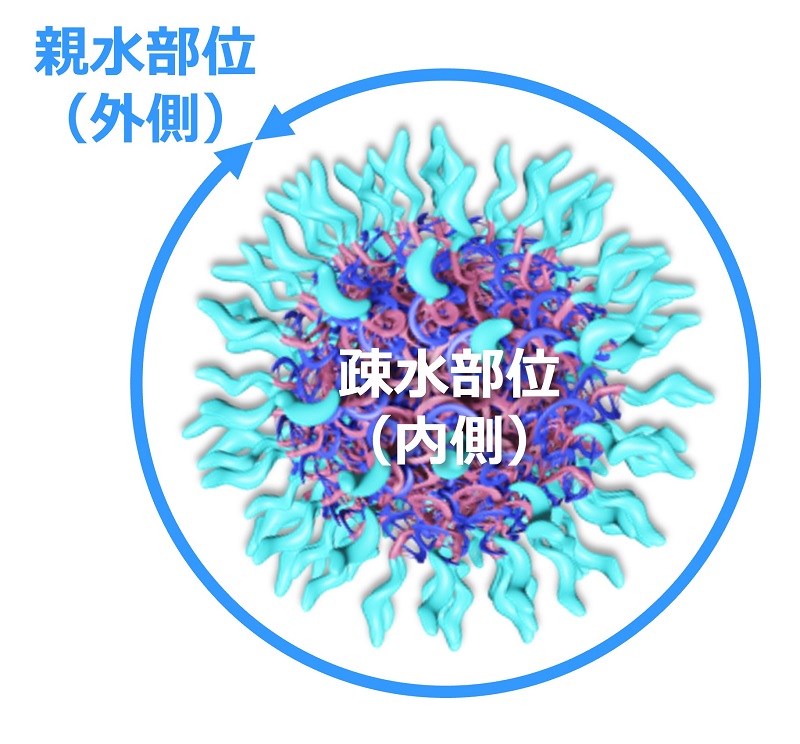
核酸のセンス鎖が正電荷を帯びる化学修飾と、親水基の導入により、核酸部位がアニーリング⇒自己組織化

疎水部位が内側に、親水部位が外側に配向するナノ粒子RIONを形成
【ナノ粒子RION形成メカニズム】

| 負電荷部位 負電荷天然核酸 (薬効成分) (アンチセンス鎖) |
正電荷部位 正電荷人工核酸 +親水基 (センス鎖) |
↓アニーリング
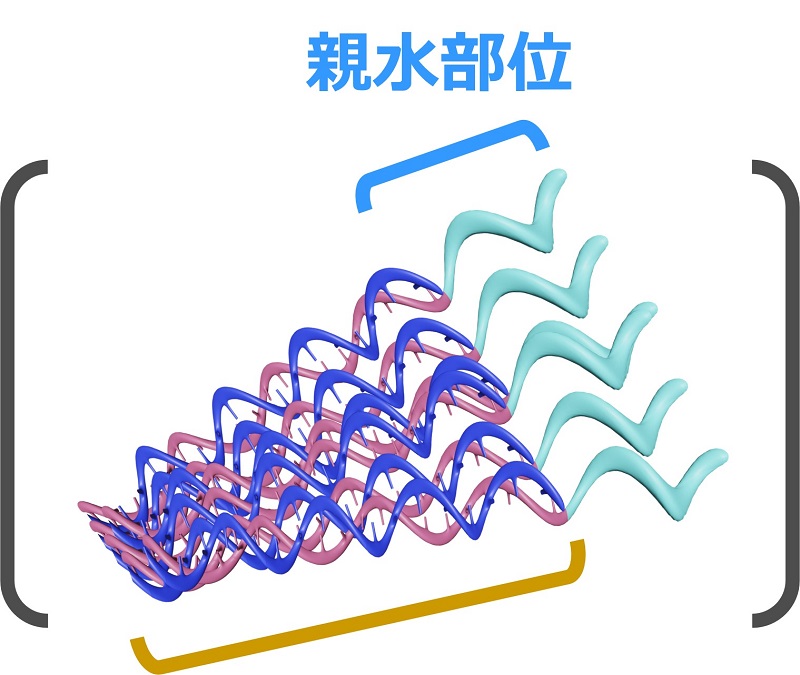
正電荷+負電荷
(疎水部位)
- ・相補的相互作用
- ・静電相互作用
↓自己組織化
従来技術との比較・優位性
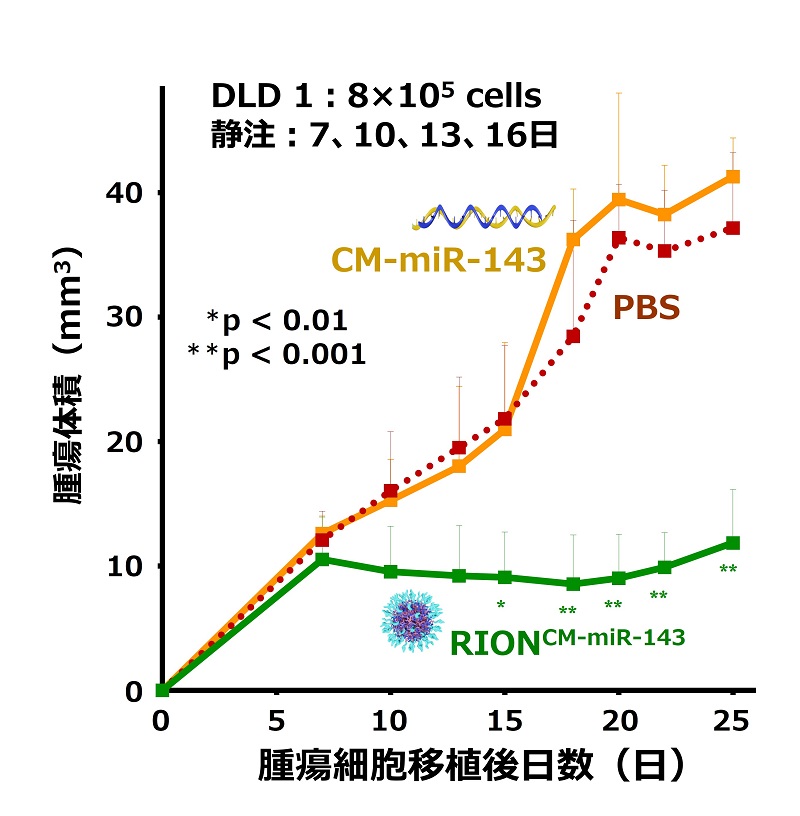
【ナノ粒子RIONの薬効】
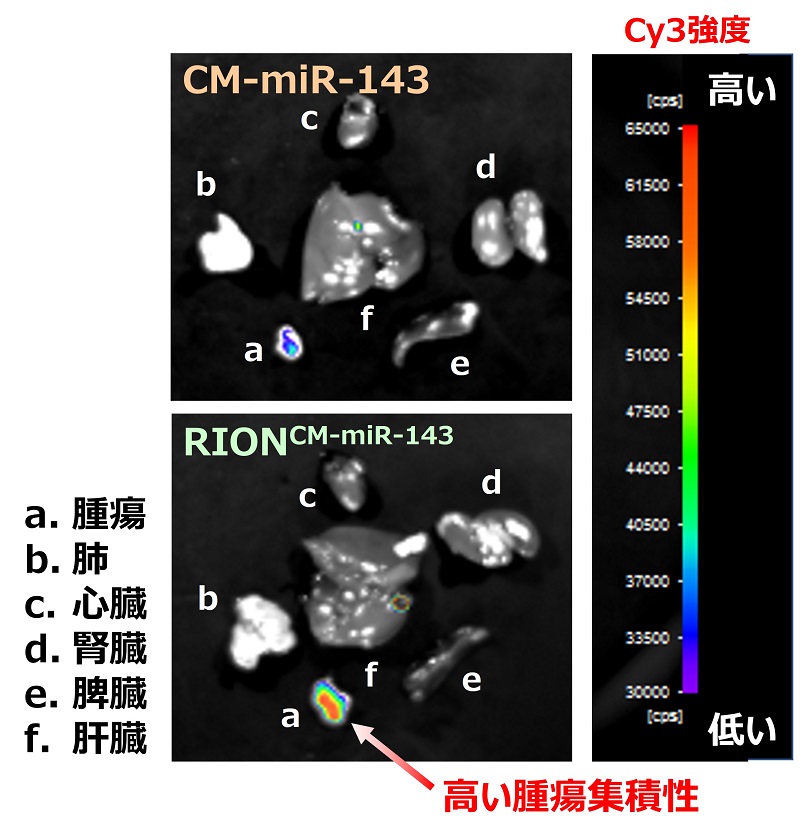
腫瘍細胞のRASシグナル伝達経路を阻害するマイクロRNA-143の化学修飾体(CM-miR-143)を基に作製した“RIONCM-miR-143”の薬効例
抗腫瘍効果(マウス、静注)
腫瘍集積性
脂質ナノ粒子(既存技術)との比較
| RION | 脂質ナノ粒子 1) | |
|---|---|---|
| 血中安定性 2) (半減期、静注) | 2.4時間 | < 15分 |
| 肝臓集積性 2) (24時間) | 不検出 | 91.4% |
| 有効成分含有率 (重量%/粒子) | 16.8% | 4.0% |
- 1)オンパットロ®点滴静注
- 2)Journal of Controlled Release, 235, 236-244 (2016)
RIONCM-miR-143は、抗腫瘍効果や腫瘍集積性が高く、既存薬剤に比べて血中安定性に優れ、有効成分含有率が高い
想定される用途
- ◎ 新規核酸医薬(がん、神経疾患、免疫疾患など)用DDSへの応用
ライセンス可能な特許
発明の名称:人工核酸、およびそれを用いた核酸の送達方法
国際公開番号:WO2022/230990
