事業成果
細胞が「自分を食べる」
オートファジーに魅せられて2019年度更新

- 水島 昇(東京大学 大学院医学系研究科 教授)
- さきがけ
- 素過程と連携「オートファジーの分子機構と生理的役割」研究者(1999-2002)
- さきがけ
- タイムシグナルと制御「哺乳動物におけるオートファジーの役割とその制御機構」研究者(2002-2005)
- SORST
- 「オートファジーによる細胞内クリアランス機構」研究代表者(2006-2007)
- ERATO
- 「水島細胞内分解ダイナミクスプロジェクト」研究総括(2017-2022)
研究手法が限られていた「オートファジー」研究
細胞が自分を食べる―そんな不思議な現象が発見されたのは1960年代。細胞が、自身のなかにあるたんぱく質を食べてアミノ酸に分解していることが、電子顕微鏡で確認された。細胞質の一部が膜で囲われ(オートファゴソーム)、そこにさまざまな分解酵素を含んだ小器官(リソソーム)が融合すると(オートリソソーム)、中身のたんぱく質が分解され、アミノ酸となる。
オートファジー(自食作用)と命名されたこの現象は、従来の生理学の常識とは異質な現象だった。たんぱく質は私たちの体内に何万種類も存在し、さまざまな働きを担っている重要な物質だ。私たちは毎日食事をし、食べ物に含まれるたんぱく質をアミノ酸へと分解・吸収する。そして、吸収されたアミノ酸は生命維持活動に必要なたんぱく質の材料となる。そんな常識からみれば、細胞に存在するたんぱく質をアミノ酸へと分解してしまうのは、いわば自分で自分を食べるような愚かな行いに思える。不要になったたんぱく質を別のものへとつくり変える新陳代謝的な意味があると推測されるが、当時は電子顕微鏡によって観察するほかに手段がなく、いつ、どこで、どのように行われているのかを確かめるのは容易ではなかった。いつしか、オートファジーは生物学の研究者の話題に上ることも少なくなり、1990年代半ばには1年間に数本の論文が発表される程度になっていた。
オートファジー
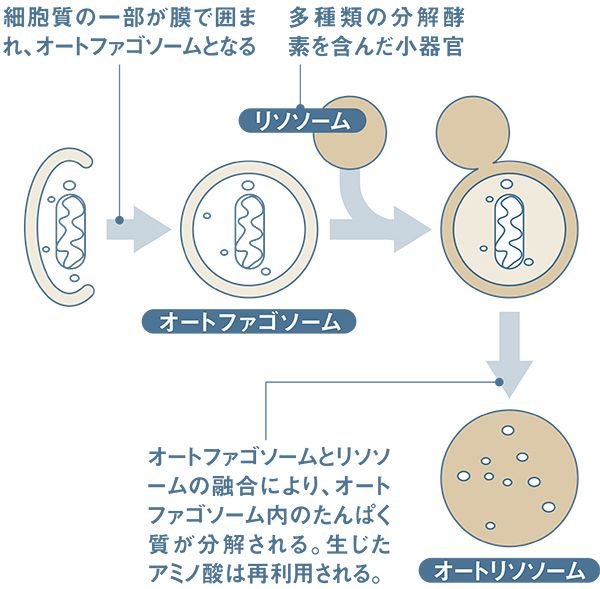
動物細胞でリアルタイムの観察手法も開発
当時、取り組む研究者が少なかったオートファジーに興味を抱いたのが、水島昇教授である。当時は東京医科歯科大学の大学院生。きっかけは、大隅良典岡崎国立共同研究機構基礎生物学研究所教授(現在は東京工業大学栄誉教授)の研究を知ったことだ。大隅教授は、遺伝学的解析が進んでいる出芽酵母にオートファジーが起こることを確認し、研究を進めていた。水島教授は、大隅教授の論文をきっかけにオートファジーという現象に惹かれ、大隅研究室の非常勤研究員となり、研究をスタートさせる。
1年後、さきがけ「素過程と連携」(大嶋泰治・研究総括)に採択され、研究を加速。Apg12とApg5という2つのたんぱく質が結合し、オートファゴソームを形成する仕組みを解明した。さらに画期的だったのは、GFPを使った細胞内可視化技術を用いて、哺乳動物でもオートファジーが全身の組織で起こっていることを確認したことだ。それまで、オートファゴソームはとても小さく、電子顕微鏡でなければとらえられなかった。オートファジーがいつ、どこで、どのように行われているのかを、リアルタイムに観察することが可能になったのだ。続けて採択されたさきがけ「タイムシグナルと制御」(永井克孝・研究総括)では、オートファジーに関わる遺伝子が欠損したノックアウトマウスを作成し、哺乳動物におけるオートファジーの役割とその制御機構の解明に取り組んでいた。
飢餓状態の栄養補給と細胞の健康維持の役割についても解明
リアルタイムでの観察やノックアウトマウスなどの研究手法の開発を機に、オートファジー研究は飛躍的に進んだ。絶食させると全身でオートファジーが活発になることや、オートファジーに必要なAtg5遺伝子を欠損したマウスが出生直後深刻な栄養不良状態に陥って死亡しまうことなどから、オートファジーが飢餓状態の栄養補給に重要な役割を果たしていることがわかった。また、神経細胞特異的にAtg5遺伝子を欠損したマウスに運動障害が現れた。神経細胞内を観察するとたんぱく質の異常蓄積と凝集化が起こっていたことから、オートファジーは、飢餓時のアミノ酸供給だけではなく細胞内の不要なたんぱく質を取り除く恒常的な役割を持つことが明らかになった。
さきがけ終了後、研究代表者となったSORST「オートファジーによる細胞内クリアランス機構」では、不要たんぱく質を取り除く役割に着目し、様々な組織におけるオートファジーの役割を調べた。例えば、マウスの受精卵では、受精後4時間以内にオートファジーが非常に活性化することを確認した。そして卵細胞特異的にAtg5遺伝子を欠損したマウスは、排卵、受精は正常に行われるものの、着床に至る前に発生が止まり死んでしまった。正常なマウスでは、受精直後にオートファジーが活性化することで、母親由来の不要なたんぱく質を取り除くとともに、発生の過程で必要となる新たなたんぱく質合成の材料となるアミノ酸を確保していたのだ。
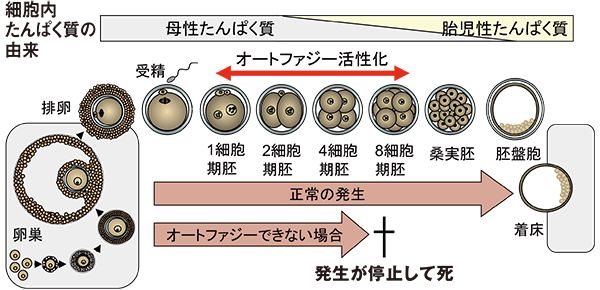
オートファジーが起こらないマウス受精卵は着床する前に発生が止まり死んでしまう
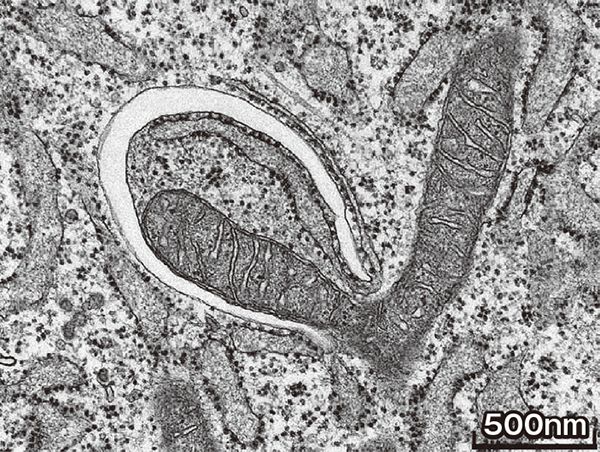
電子顕微鏡がとらえたオートファゴソーム形成の瞬間。ミトコンドリア(中央V字形)が、白く見える隔離膜(中央左上)に取り囲まれようとしている。(撮影:岸 千絵子)
世界中から注目を集める研究分野に
このように、水島教授らは、新たに開発した観察方法を用いて、オートファジーが酵母のみならず生物全般での普遍的な機能であることを明らかにし、仕組みや役割の解明を続けてきた。それは、世界中でオートファジーの研究が活性化するきっかけともなり、がんやアルツハイマーなどの病気の治療につながる道も示されようとしている。2013年には、トムソン・ロイター引用栄誉賞に、水島教授が大隅教授らとの共同受賞で選ばれた。同賞は、自身の論文が他の論文で引用された数が選考基準となっており、受賞者はノーベル賞の有力候補とも言われる。年に数本しか関連論文が出なかった頃からわずか十数年。先見の明を持った水島教授らの研究成果をきっかけに、オートファジーは世界が注目する研究分野に成長している。
オートファジーの分子メカニズムの解明
脊椎動物を主な対象としたオートファジーの分子メカニズムの解析も進んでいる。ERATO「水島細胞内分解ダイナミクスプロジェクト」では、ゲノム編集技術を用いたヒト全遺伝子を対象とした網羅的探索から酵母には存在しない新しいオートファジー因子を発見し、さらに小胞体を選択的に認識するオートファジー受容体も発見した。物理や分子進化などの新しい視点も含めながら分野横断的研究が進行中である。
- ライフサイエンスの成果一覧へ
- 事業成果Topへ
- English