事業成果
生体内高分子の3次元構造を解析
クライオ電子顕微鏡による新手法を開発2020年度更新

- 日本電子株式会社/藤吉 好則(東京医科歯科大学 特別栄誉教授)
- 産学共同実用化開発事業(NexTEP)
- 「実環境高分解能3次元生体構造解析システム」開発実施企業/代表研究者(2015-2019)
最新鋭クライオ電子顕微鏡に新たな手法を用いることで生体内高分子の3次元構造解析を世界最高レベルの分解能で実現
たんぱく質など生体内高分子の3次元構造は生命科学や創薬の研究に欠かせない基盤情報である。ここ数年で急増しているのが、クライオ(低温)電子顕微鏡によるたんぱく質の構造解析だ。NexTEPの開発実施企業である日本電子株式会社と代表研究者の藤吉好則教授は、日本で最初にクライオ電子顕微鏡を開発し、30年以上にわたって改良を重ねてきた。最新の装置には、従来は困難だった脂質膜中のたんぱく質の構造解析を可能にする新たな技術を搭載している。たんぱく質や薬剤の3次元構造を世界最高レベルの分解能で解析できると注目が高まっている。

図1 NexTEPによる新技術を搭載した最新鋭クライオ電子顕微鏡
「水チャネル」と呼ばれる膜たんぱく質の3次元構造を電子線結晶学で解明
クライオ電子顕微鏡は生体内高分子を低温に急冷することで、試料を真空環境にさらすことなく、また電子線による損傷も低減できるのが特徴だ。2017年のノーベル化学賞は、クライオ電子顕微鏡の基礎技術を生み出した欧米の3人の研究者が受賞したが、日本でも1970年代後半の黎明期から、日本電子と藤吉教授が二人三脚で独自に開発を続けてきた。1986年には、世界に先駆け、電子線照射による損傷を極限まで抑えた第1号機の開発に成功した。
日本電子と藤吉教授がこれまで共同開発してきたクライオ電子顕微鏡による大きな成果に、「水チャネル」と呼ばれる膜たんぱく質の電子線結晶学を用いた構造解析がある。人間の身体の約70%は水でできており、生命や脳機能を健全に保つには、水分子しか通過させない水チャネルが重要な役割を果たす。人間の身体には、アクアポリン0からアクアポリン12まで13種類の水チャネルが存在している。特に多くの組織で見られるアクアポリン1は、1秒間に30億個もの水分子を通しながらも、いかなるイオンもプロトンも通さない。この不思議なしくみを解明するため、藤吉教授は日本電子と共同開発したクライオ電子顕微鏡を使い、電子線結晶学を駆使することで、アクアポリン1の3次元構造を世界で初めて解析した。その結果、水分子中の水素の向きによって、水分子のみが選択的かつ高速に水チャネルを透過していることを明らかにした。
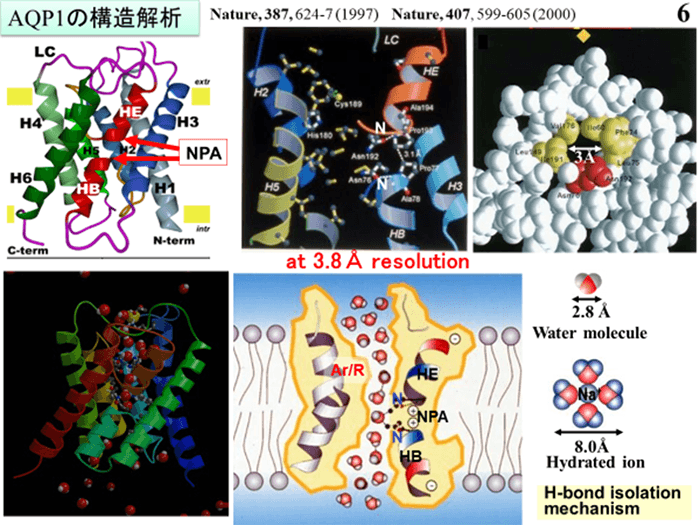
図2 CAP:アクアポリン1の3次元構造解析結果
生体内高分子の新たな3次元構造解析法「IBSA法」を実現
電子線結晶学では、脂質膜中の膜たんぱく質を構造解析するには、脂質膜の中から取り出し、結晶化する必要があった。一方で、水チャネルのような膜たんぱく質は脂質膜の中にあって初めて、その機能を発揮する。そこで、藤吉教授が新たに考案したのが、「IBSA(イブサ)法(IBSA=Image Based Structure Analysis)」と呼ばれる構造解析法だった。これは、1つの生体内高分子の画像を傾斜した条件で高分解能像を撮影した後に、同一視野を非傾斜の条件で撮影し、その非傾斜の画像を参照することで、最初に撮影した像から3次元構造を構築する方法だ。
そこで、NexTEPにおいて、日本電子と藤吉教授は、IBSA法の技術を搭載したクライオ電子顕微鏡の共同開発を進めた。具体的には、日本電子がクライオ電子顕微鏡の開発をし、藤吉教授がIBSA法のデータ収集ソフトウェアと解析ソフトウェアの開発を担当した。その結果、酵素の1つであるβ-galactosidase)※1について、FSC(Fourier Shell Correlation)法※2による評価(FSC=0.143)で分解能0.27ナノメートルを得ることができ、2019年5月、NexTEP開発課題の成功認定を受けるに至った。
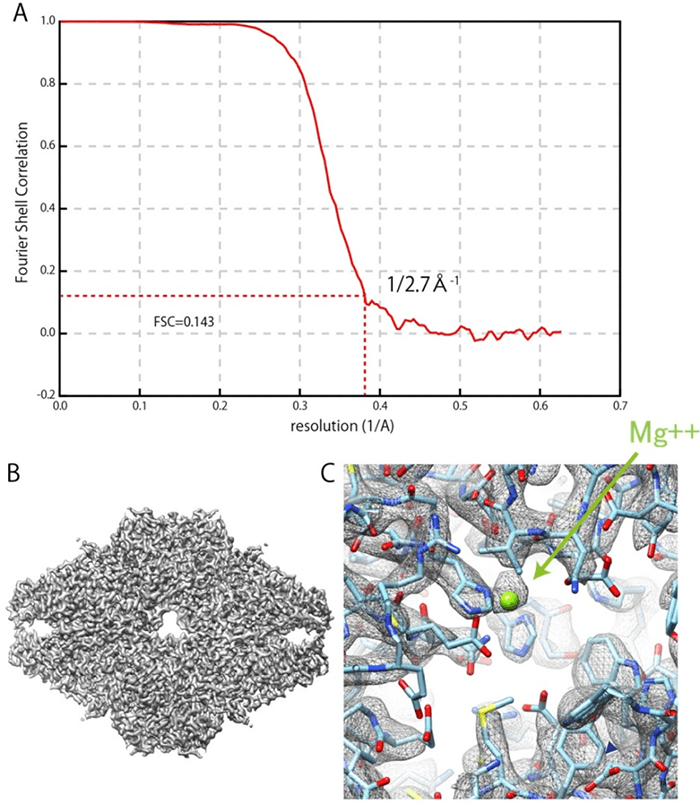
図3 β-galactosidaseの3次元再構成結果
(A)FSCプロット。赤破線はFSC=0.143を示しており、赤実線と最初に交差した箇所から分解能0.27ナノメートルを定義している。
(B)3次元再構成したマップと原子モデル。
(C)酵素活性部位のマグネシウムイオン。
※β-galactosidase
大腸菌由来のたんぱく質であり、四量体で機能し、ラクトースをグルコースとガラクトースに分解する酵素。X線構造解析により古くから構造解析されている。
※FSC(Fourier Shell Correlation)法
分解能推定法の1つ。電子顕微鏡写真から解析のために選び出した粒子をランダムに2つのグループにあらかじめ分け、それぞれのグループで独立に3次元構造を再構成する。
得られた独立の3次元構造をフーリエ変換し、任意の分解能の範囲ごとに2つのグループ間の相関を計算する。相関値であるFSCが0.143に初めて到達した分解能位置を解析結果の分解能として定義する場合が多い。
遠隔操作システムで最新のクライオ電子顕微鏡の利用が可能に
2017年4月、藤吉教授と日本電子は共同出資により、CeSPIA(セスピア、東京都千代田区)という企業を設立している。同社では、創薬のための3次元構造解析の受託とコンサルティング業務を行っており、試料をCeSPIAに送れば、クライオ電子顕微鏡による高分解能の構造解析結果を手頃な価格で得ることができる。
また、今回開発した最新のクライオ電子顕微鏡は、現在、日本電子内に設置されており、東京医科歯科大学の研究室からでもモニター画面を見ながら遠隔操作することができる。クライオ電子顕微鏡は、1台数億円と高額で維持管理も大変なことから、今後、日本電子では、購入が難しい企業や研究機関に対し、遠隔操作システムを導入してもらうだけで、クライオ電子顕微鏡を共同利用できることも計画している。

図4 遠隔操作によるクライオ電子顕微鏡の共同利用を計画
- ライフサイエンスの成果一覧へ
- 事業成果Topへ
- English