- 【平野チーム】「炎症アンプと様々な疾患との関連」 Cell 2012、Cell Reports 2013
- 【岩倉チーム】「細菌感染防御におけるIL-17AとIL-17Fの役割」Immunity 2009
5.免疫系におけるサイトカインの役割
病原体に対する免疫系の攻撃としては、主に好中球やマクロファージなどの自然免疫系の貪食細胞による貪食作用、キラーT細胞による細胞傷害性物質の放出による宿主細胞の破壊、B細胞が産生する抗体による病原体の不活化などがあります。このような免疫細胞の活性化や機能抑制には、サイトカインと総称される生理活性蛋白質が重要な役割を担っています。サイトカインには白血球が分泌し、免疫系の調節に機能するインターロイキン類、白血球の遊走を誘導するケモカイン類、ウイルスや細胞の増殖を抑制するインターフェロン類など、様々な種類があり、今も発見が続いています。サイトカインは免疫系のバランスの乱れなどによってその制御がうまくいかなくなると、サイトカインストームと呼ばれるサイトカインの過剰な産生状態を引き起こし、ひどい場合には致死的な状態に陥ります。サイトカインは本来の病原体から身を守る役割のほかに、様々な疾患に関与していることが明らかになってきています。
平野チームは、自ら発見したサイトカインの一種であるIL-6が自己免疫疾患の発症制御において、中心的な役割を担っていることを独自に開発した疾患モデルマウスを用いて明らかにしています。また、免疫細胞の中枢神経系への侵入口を発見したことから、神経系自己免疫疾患の発症仮説を提唱しています。岩倉チームは、炎症性サイトカインであるIL-17ファミリー分子の機能的役割を解析する中で、これらファミリー分子が感染防御と炎症抑制において、役割分担されていることを見出しています。
【平野チーム】「炎症アンプと様々な疾患との関連」 Cell 2012、Cell Reports 2013
<ポイント>
- 炎症アンプ注1)がどのようなヒト疾患に関与しているか不明だった。
- 凍結切片やヒト疾患関連遺伝子データベース注2)を用いたユニークな解析により、中枢神経系の自己免疫疾患や慢性炎症性疾患との関連が明らかになった。
- 炎症アンプに関連する疾患のための分子標的となる。
「免疫細胞の中枢神経系への侵入口と仕組みを世界で初めて解明」 Cell 2012
-脳や脊髄系の病気の新たな予防、治療へ-
中枢神経系注3)の臓器である脳や脊髄の血管は、血液を介する細菌やウイルスなどの影響を極力防ぐために特殊な関所としての血液脳関門注4)を形成しています。血液脳関門は、免疫細胞を含む血液系の細胞はもとより、大きなたんぱく質なども脳や脊髄に通過させません。しかし、中枢神経系にも細菌やウイルスが感染し、がんや炎症などに起因する難病注5)が発症します。また血液に存在する免疫細胞は、このような病態や病気を防ぐ一方で、ある時はそれらの原因となったり、悪化させたりすることもあります。こうした背景から、血液脳関門には、病原菌や免疫細胞などが中枢神経系に入るためのゲートがある可能性が示唆されていました。しかし、そのゲートがどこにあるのか、またどのように形成されるのかなど、実体は不明でした。
多発性硬化症注6)の動物モデルである実験的自己免疫性脳脊髄炎(EAE)注7)をマウスに発症させ、EAEの原因となる自己反応性T細胞を正常マウスの血管内に移入すると、正常マウスの中枢神経系にEAEが誘導されます。これは、血液中の自己反応性を持つ病原性T細胞が血液脳関門を越えて、中枢神経系に侵入したことを示すものです。そこで本研究グループは、この実験モデルを用いて、血液脳関門のゲートの部位とゲートがどのように形成されるのかを調べることにしました。
まず、EAEを発症したマウスから病原性T細胞を単離して正常マウスの血管内に移入しました。それらの細胞が、血管内から中枢神経系に入り込む部位を特定するために、切削器具のマクロトームを用いて脊髄を薄くスライスし、蛍光顕微鏡で解析しました。その結果、血管内の病原性T細胞は、第5腰椎の背側の血管から、脊髄に入ることを世界で初めて突き止めました(図1)。
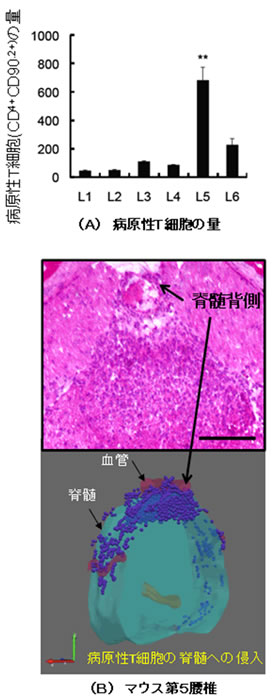
図1 マウス脊髄の凍結切片における病原性T細胞の集積
(A)フローサイトメトリーによる第1(L1)~第6(L6)腰椎における病原性T細胞の量。第5腰椎(L5)で病原性T細胞が集積していることが分かる。
(B)蛍光顕微鏡による第5腰椎の断面の観察。病原性T細胞が第5腰椎の背側の血管から脊髄へ侵入している様子が分かる。
次に、なぜその部位のみが病原性T細胞の中枢神経系へのゲートとなっているのか、その仕組みを調べました。その結果炎症アンプと呼ばれる炎症を誘導する仕組みが第5腰椎の背側の血管内皮細胞注8)で活性化することで、CCL20というケモカイン注9)が血管内皮細胞に発現し、血液内の病原性T細胞を呼び寄せて中枢神経系へのゲートを形成していることが分かりました(図2)。
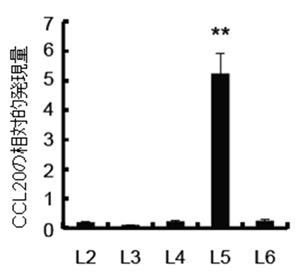
図2 各腰椎のCCL20の量
このように、第5腰椎の背側の血管内皮細胞でIL-6アンプが活性化されている原因を解明するにあたり、研究グループではヒラメ筋からの感覚神経注10)が第5腰椎の背側に位置する神経節で脊髄につながっていることに着目しました。ヒラメ筋はふくらはぎ付近に存在して重力を受け止めている筋肉として知られていますが、絶え間ない重力刺激に対抗するヒラメ筋の応答が感覚神経を介して第5腰椎の背側で脊髄に伝わり、この刺激が近傍の血管でIL-6アンプを活性化しているのではないかという仮説をたてました。
この仮説を実証するために、マウスのしっぽを天井からつるし(後肢懸垂法)、ヒラメ筋への重力刺激をなくした時の影響を調べました。その結果、第5腰椎の背側の血管におけるCCL20の発現および病原性T細胞の集積は見られず、EAEの発症も明らかに抑制されました。また、後肢懸垂モデルのマウスのヒラメ筋に電気刺激を与えると電気刺激を与えた時間にCCL20の発現量が比例することや第5腰椎の血流速度が速くなることが見いだされました。血流速度は交感神経注11)の活性化により速くなります。これらの結果から、重力に対抗するために緊張するヒラメ筋から脊髄に伝えられる感覚神経の活性化は近傍の交感神経の活性化を引き起こしていることが推測されました(図3)。
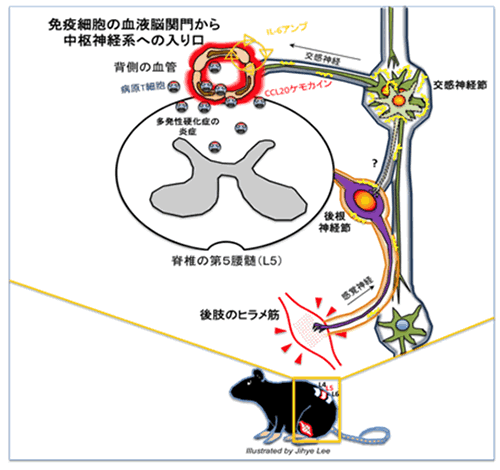
図3 まとめ
今回の研究結果から、中枢神経系の血液脳関門に免疫細胞が血管から通るためのゲートが、神経刺激によって形成されることが明らかとなりました。今後、人為的に神経の活性化を抑制または刺激することで、そのゲートを人為的に閉じたり形成したりすることが可能になり、中枢神経系の感染、がん、難病などの予防や治療につながることが期待されます。
神経の活性化は、今回の実験で明らかにした重力ばかりではなく、現代生活につきまとうストレスなどさまざまな外的な刺激でも生じます。そのため、今回の成果により、さまざまな病気が精神的なストレスなどで増悪する仕組み、あるいは、適度な運動が病気・病態を改善するメカニズム、さらに、針治療によってなぜ多くの病気・病態が改善するのかなど、今まで不明であった神経や精神と免疫系の相互作用の分子基盤が解明されることが期待されます。
さらに、中枢神経系ばかりではなく体のさまざまな臓器においても、免疫細胞が特定の臓器に集積することで、関連する交感神経や副交感神経が活性化あるいは不活性化し、血管の活性化状態を調節している可能性も考えられます。このことは、多くの臓器特異的自己免疫疾患注12)や慢性炎症性疾患の発症機構も、特定の神経の活性化による特定の血管へのゲートの形成によって説明できる可能性を示唆し、その神経の活性化を制御することにより、新たな治療法の開発に結びつくことが期待されます。
<原論文情報>
“ Regional neural activation defines a gateway for autoreactive T cells to cross the blood-brain barrier ”
(局所的な神経の活性が、病原T細胞の血液脳関門の通過ゲートを形成する。)
Cell. 2012 Feb 3;148(3):447-57. doi: 10.1016/j.cell.2012.01.022.
Arima Y1, Harada M, Kamimura D, Park JH, Kawano F, Yull FE, Kawamoto T, Iwakura Y, Betz UA, Marquez G, Blackwell TS, Ohira Y, Hirano T, Murakami M.
<共同研究者>
本研究は、大阪大学 大学院医学系研究科の大平 充宣教授、東京大学 医科学研究所の岩倉 洋一郎 教授らの協力を得て行いました。
「炎症アンプはさまざまな病気に関連していた!」Cell Reports 2013
自己免疫疾患などの慢性炎症性疾患は、未だに根治が難しい病気です。最近では動脈硬化やメタボリック症候群、神経変性疾患などにも慢性炎症が関与していると考えられています。慢性炎症性疾患が難病である原因のひとつは、その分子レベルでの発症機構がよく分かっていないという点にありました。我々の研究室ではマウスの自己免疫疾患モデルを用いてこの分子機構について研究を進めてきました。炎症部位には免疫細胞の浸潤が認められますが、我々は、免疫細胞というよりはむしろ血管等を構成する内皮細胞や線維芽細胞といった非免疫系の細胞から多量の炎症性因子(サイトカインやケモカイン)が産生されることが自己免疫疾患の発症に重要であることをマウスの病気のモデルで明らかにしてきました。この炎症の根源ともいえる多量の炎症性因子の産生機構を『炎症アンプ』と命名し、その分子機構として転写因子注13)STAT3 とNF-kB注13)の同時活性化が重要であることを以前から報告しています(図4)。今回の研究では、全遺伝子を網羅した機能的スクリーニングを行い、炎症アンプの分子基盤をより詳細に明らかにしました。またこの機能的スクリーニングで得られた炎症アンプ関連遺伝子をヒトの疾患関連遺伝子と比較することによって、炎症アンプがどのようなヒトの病気と関係があるのかを調べました。
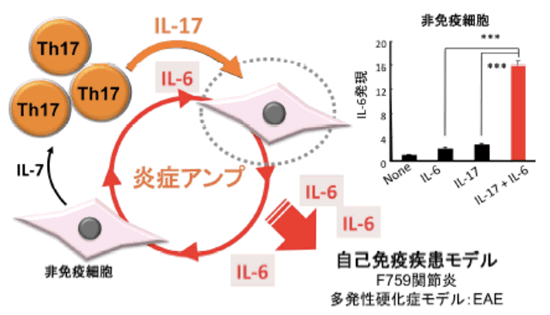
図4 炎症アンプは非免疫系細胞の炎症誘導機構である
本研究で用いたスクリーニング法は、特定の遺伝子機能を阻害することができるshRNA を利用したもので、約16,000 遺伝子についてそれぞれ遺伝子機能を阻害し、炎症アンプの活性化に与える遺伝子群を網羅的に探索しました。その結果、約1000 遺伝子が炎症アンプの活性化を制御していることが判明しました。さらに、炎症アンプの活性化によってどのような遺伝子が誘導されるかをスクリーニングするために、DNA アレイ法を用いて解析し、マウスの細胞において約500 遺伝子、ヒトの細胞では約800 の遺伝子が炎症アンプの活性化で発現する標的遺伝子であることが分かりました。
これまでの炎症アンプの研究はマウスを使った実験が多く、ヒトの病気に関係しているかどうかは推測の域をでませんでした。このことから、ヒトの疾患関連遺伝子データベースを利用するということを考えました。このデータベースにはヒトのさまざまな疾患に関係する遺伝子の情報が世界中から集められています。我々の行った3 種のスクリーニングで同定された炎症アンプの制御遺伝子群および標的遺伝子群が、このデータベースの疾患関連遺伝子群をどれだけ含むのかを検討したところ、任意に抽出した遺伝子群と比較して、今回同定できた炎症アンプの制御遺伝子群および標的遺伝子群には有意に多くの疾患関連遺伝子が含まれることが分かりました。またその疾患関連遺伝子群には、自己免疫疾患に関するものばかりではなく、最近慢性炎症が関わることが示唆されているメタボリック症候群やアルツハイマー病等の神経変性疾患に関連するものも多く含まれていました(図5)。この結果は、炎症アンプがヒトのさまざまな疾患に関連することを示しています。また今回の研究で、全遺伝子を対象とするような大規模なスクリーニングで得られる大量のデータを、ヒト疾患関連遺伝子データベースの情報と照らし合わせることによって、ヒトの病気との関連性を明らかにするという新たな解析法(reverse-direction 法)を確立しました。
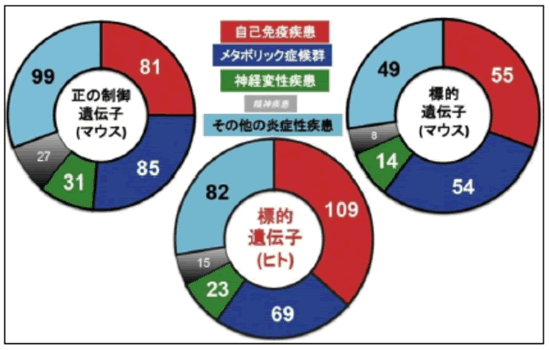
図5 炎症アンプはヒトのさまざまな疾患に関連する
我々はさらに、大規模スクリーニングによって同定した炎症アンプの制御遺伝子であり、標的遺伝子でもあり、また疾患関連遺伝子としても報告されている遺伝子である受容体ErbB1 とそのリガンドであるエピレグリンについて詳細な解析を行いました。エピレグリンは可溶性の増殖因子であり、細胞表面の受容体ErbB1 に結合して細胞内信号伝達を誘導します。細胞株の実験では、ErbB1受容体の機能を低下させるもしくはErbB1 信号伝達の阻害剤を添加すると炎症アンプの活性化が大きく減弱し、反対に増殖因子エピレグリンを加えるとその活性化が有意に増強されました。また、関節リウマチや多発性硬化症のマウスモデルにおいて、エピレグリンの作用の抑制やErbB1 信号伝達阻害剤がその病状を著しく改善することを証明しました(図6)。さらに重要なことに、関節リウマチ、多発性硬化症および動脈硬化の実際の患者さんの血液中のエピレグリン量は、健康な人たちの量よりも有意に増加していました(図7。この結果は、増殖因子エピレグリンがヒトの慢性炎症性疾患の疾患マーカーや治療標的として利用できる可能性を示しています。
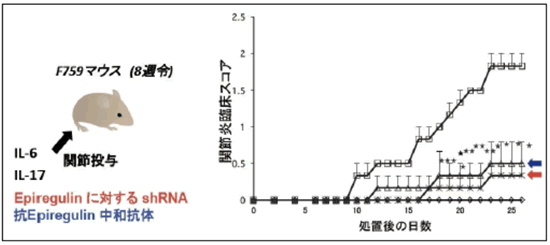
図6 エピレグリンの作用を阻害するとマウスの関節炎が軽減する
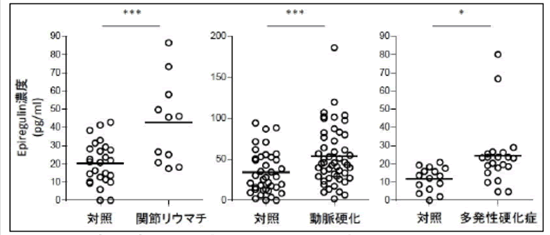
図7 エピレグリンは患者の血清中で高い値を示す
<用語解説>
- 注1)炎症アンプ
- 本研究グループが発見した局所の炎症誘導機構。血管を構成する内皮細胞や組織の線維芽細胞といった非免疫系の細胞が、転写因子STAT3 およびNF-kB を同時活性化させるような因子(サイトカイン)によって刺激を受けると、非常に大量の炎症性因子(サイトカインやケモカイン)が発現誘導される分子機構。
- 注2)ヒト疾患関連遺伝子データベース
- ヒトの病気と遺伝子変異との相関関係を明らかにした研究結果を世界中から集めたデータベース。本研究で利用した米国国立衛生研究所のGenetic Association Database はそのひとつ。
- 注3) 神経系
- 脊椎動物の神経系は脳や脊髄からなる中枢神経系と、体性神経系および自律神経系からなる末梢神経系に分かれる。中枢神経系は神経細胞が集まった塊であるのに対し、末梢神経系は神経節と神経繊維からなり、体の各部と中枢神経系の間で神経刺激を伝達する役割を果たす。体の感覚や運動を制御する体性神経系には感覚神経と運動神経があり、内臓や血管などを自動的に制御する自律神経系には交感神経と副交感神経がある。
- 注4) 血液脳関門
- 中枢神経系の血管に備わっている、血液と中枢神経系の組織液との間で物質交換を制限する機構で、中枢神経系の血管を構成する内皮細胞が非常に強固に結合しあって血液中の大きなたんぱく質や免疫細胞などを中枢神経系の中に通過させないように機能している。
- 注5) 難病
- 現在治療法がない病気のことで、中枢神経系の難病には多発性硬化症、アルツハイマー病、パーキンソン病などがある。
- 注6) 多発性硬化症
- 中枢神経系の神経細胞には軸索と呼ばれる突起があるが、軸索を包んでいるミエリンという絶縁性のリン脂質が炎症により壊され(脱髄という)、他の神経細胞との間で情報伝達がスムーズに行えなくなって麻痺やしびれをきたす疾患。脱髄が生じる詳しいメカニズムはまだ分っていないが、免疫系の異常の可能性が高いといわれている。
- 注7) 実験的自己免疫性脳脊髄炎(EAE)
- ミエリンオリゴ糖たんぱく質などの特定のたんぱく質をマウスに注射すると、多発性硬化症に似た脳脊髄炎を発症する。これはミエリンを抗原と認識して反応するT細胞(病原性T細胞)が誘導され、それが中枢神経系に侵入することで、自己のミエリンを攻撃し(自己反応性)、脱髄を起こすためと考えられている。実験的自己免疫性脳脊髄炎は多発性硬化症の動物モデルとして使われている。
- 注8) 血管内皮細胞
- 血管のうち表面を構成する扁平で薄い細胞のことで、血管の内外への物質の出入りを制御するなど、器官によってもさまざまな機能を持っている。
- 注9) ケモカイン
- 接着分子と呼ばれるサイトカインの一種でさまざまな種類がある。ケモカインが発現した部位にはそのケモカインを受け取ることができる細胞が集まって来て炎症誘導の起点となる。T細胞などの免疫細胞は血管内の血液にのって全身を巡り、生体の防御に携わっている。血管内皮細胞が病原体などの情報を得ると血管内皮細胞上にケモカインを発現し、対応するケモカイン受容体を発現している免疫細胞が結合することで免疫細胞は血管外へと浸潤することが出来る。
- 注10) 感覚神経
- 体性神経系のうちの、感覚器や筋肉の受容器から脳に信号を伝える求心性の神経。
- 注11) 交感神経
- 自律神経のうち、内臓や血管の状態を制御する神経の1種類でノルアドレナリンなどを末端から出して血管を収縮させる。
- 注12) 臓器特異的自己免疫疾患
- 生体を防御するための免疫系が自分自身の正常な細胞や組織に対してまで攻撃してしまう自己免疫疾患の中で、特定の臓器だけが影響を受ける疾患のことで、慢性甲状腺炎や多発性硬化症などがある。全身性の自己免疫疾患には関節リウマチや全身性エリテマトーデスなどがある。
- 注13)転写因子
- 細胞のDNA に配列特異的に結合するタンパク質で、遺伝子のmRNA 転写を調節する。STAT3 やNF-kBは有名な転写因子であり、多くの標的遺伝子が同定されている。炎症アンプでは、サイトカインによって活性化したSTAT3 とNF-kB が協調的に作用すると、それぞれが単独で働いた時に比較して、相乗的な効果が生まれる。図1参照。
<原論文情報>
“Disease-Association Analysis of an Inflammation-Related Feedback Loop”(炎症アンプの疾患関連解析)
Cell Rep. 2013 Mar 28;3(3):946-59. doi: 10.1016/j.celrep.2013.01.028. Epub 2013 Feb 21.
Murakami M1, Harada M, Kamimura D, Ogura H, Okuyama Y, Kumai N, Okuyama A, Singh R, Jiang JJ, Atsumi T, Shiraya S, Nakatsuji Y, Kinoshita M, Kohsaka H, Nishida M, Sakoda S, Miyasaka N, Yamauchi-Takihara K, Hirano T.
【岩倉チーム】「細菌感染防御におけるIL-17AとIL-17Fの役割」Immunity 2009
<ポイント>
- 炎症性サイトカインIL-17Aは自己免疫やアレルギー応答、細胞外増殖性細菌感染防御などで中心的な役割を果たしている。
- IL-17Aと相同性の高いIL-17Fは主に日和見感染からの防御に役立つことがわかった。
- 免疫疾患や感染症への新たな治療法確立に期待
CD4+ヘルパーT細胞は免疫応答の中心的な役割を果たしており、これまでに、IFN-γを産生する1型ヘルパーT(Th1)細胞とIL-4を産生するTh2細胞とよばれる2つのサブセットがあることが分かっていました。Th1細胞は主に細胞性免疫や細胞内寄生体の排除に関与する一方、Th2細胞は液性免疫や細胞外寄生体に対する感染防御に関与すると考えられています。ところで、IL-17(IL-17A)は主に活性化T細胞より産生され、線維芽細胞や上皮細胞、血管内皮細胞、マクロファージなど種々の細胞に作用して、様々な炎症性メディエーターの発現を誘導する炎症性サイトカインと言われる分子です。最近、IL-17Aを産生するCD4+T細胞はTh1やTh2細胞とは異なるTh17と呼ばれるサブセットであり、この細胞集団が自己免疫やアレルギー応答、細胞外増殖性細菌感染防御などで中心的な役割を果たしていることが次第に明らかとなり、大いに注目されております。 IL-17Aには相同性を持つ6個のファミリー分子(IL-17A?F)が存在することが報告されています。IL-17FはIL-17ファミリーの中で最もIL-17Aと相同性が高く、IL-17Aとレセプターを共有していることから、この分子も炎症性疾患の発症に重要な役割を果たしているのではないかと考えられてきましたが、これまで生体内におけるIL-17Fの役割は実際にはほとんど解析されておりませんでした(図1)。
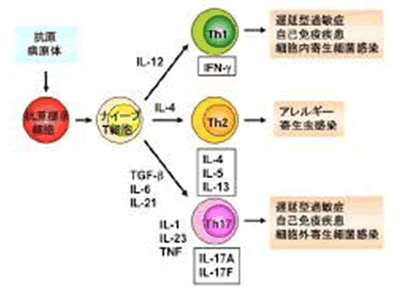
図1. ヘルパーT細胞の作用
本研究では、IL-17A欠損マウスの他に、新たにIL-17F欠損、およびIL-17A/F二重欠損マウスを作製することにより、IL-17Fの役割を解析しました.その結果、実験的自己免疫性脳脊髄炎やコラーゲン誘導関節炎、IL-1レセプターアンタゴニスト欠損マウスに自然発症する関節炎などの自己免疫疾患や、遅延型過敏症や接触型過敏症などのアレルギー性炎症応答の発症においては、IL-17Fではなく、IL-17Aが中心的な役割を果たしていることがわかりました。一方、日和見感染菌である黄色ブドウ球菌(Staphylococcus aureus)やマウス病原性大腸菌であるCitrobacter rodentium の粘膜上皮感染防御においては、IL-17FはIL-17Aと同等か、むしろIL-17Fの方が重要な役割を果たしていることが明らかとなりました。これには、腸管上皮におけるディフェンシンの発現誘導が関与していることが示唆されました.興味深いことに、IL-17Aは主にT細胞から産生されるのに対し、IL-17FはT細胞だけでなく、自然免疫細胞や上皮細胞からも産生されていました(図2)。また、マクロファージやT細胞からはIL-17Aのみが効率的に炎症性メディエーターを誘導できるのに対し、上皮細胞の場合は、IL-17AとIL-17Fのどちらもが作用し免疫応答を活性化できることが分かりました(図3)。
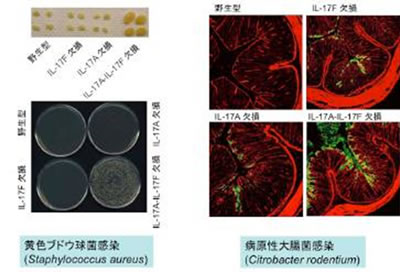
図2. 粘膜上皮への細菌感染防御にはIL-17AとIL-17Fのどちらもが重要な役割を果たしている
これらの結果は、自然免疫を介した細菌感染防御機構の一端を明らかにしたもので、選択的にIL-17Aを阻害できれば感染防御能を維持したまま炎症反応を抑制できる可能性や、IL-17Fを選択的に発現誘導することにより炎症応答を伴わずに細菌感染防御能を高めることができる可能性、などを示唆しており、アレルギー疾患や感染症に対する新たな予防・治療法の開発に役立つものと考えております。
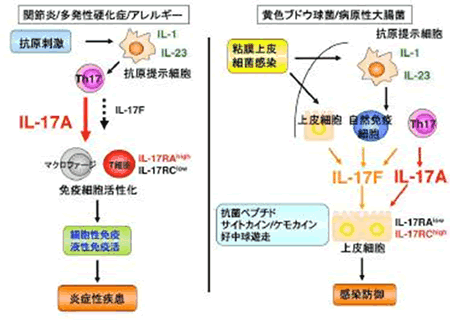
図3. IL-17AとIL-17Fの役割の違い
<原論文情報>
“Differential roles of interleukin-17A and -17F in host defense against mucoepithelial bacterial infection and allergic responses”
(IL-17AとIL-17Fの生体防御とアレルギー応答における異なる役割)
Immunity. 30: 108 ( 2009)
Ishigame H1, Kakuta S, Nagai T, Kadoki M, Nambu A, Komiyama Y, Fujikado N, Tanahashi Y, Akitsu A, Kotaki H, Sudo K, Nakae S, Sasakawa C, Iwakura Y.

