事業成果
クロマチンにおけるDNA修復機構の解明
切断された二本鎖DNAがクロマチン上で修復される仕組みを解明2025年度更新

- 胡桃坂 仁志(東京大学 定量生命科学研究所 クロマチン構造機能研究分野 教授)
- ERATO
- 「胡桃坂クロマチンアトラス」研究代表者(2019-2024)
クロマチン上でRAD51が二本鎖DNA切断修復を開始する仕組みを解明
東京大学定量生命科学研究所クロマチン構造機能研究分野の胡桃坂仁志教授らの研究グループは、DNA修復タンパク質のRAD51が、クロマチン内の二本鎖DNAが切断した部位を見つけ出し、DNAの修復を開始するメカニズムを明らかにした。
真核生物のゲノムDNAは、ヒストンタンパク質に巻き付いてクロマチンと呼ばれる複合体を形成する。クロマチンは折り畳まれることで細胞核内に収納されているが、遺伝子発現に応じてその構造を動的に変化させる。
胡桃坂教授らの研究グループはこれまで、クロマチンの構造変化とDNA機能制御発現を解明するとともに、それらの構造情報を核内空間において地図のように記した「クロマチンアトラス」という概念の確立を目指して研究を進めてきた。
この成果は、「クロマチンアトラス」確立への前進と、DNAの二本鎖切断が原因となるがん発症メカニズムの解明に貢献することが期待される。
RAD51は切断されたDNAをどのように修復するのか
生物の設計図であるゲノムDNAは、紫外線や細胞の代謝により、日常的にDNA損傷※1を受けている。特に、放射線などにより生じる二本鎖DNAの切断は、日本人の死亡原因の一位であるがん発症の原因となる。ただし、切断されたDNAの多くは、DNA修復機構によって修復される。RAD51は、このDNA修復に関わるタンパク質のひとつとして知られている。
ヒトを含む真核生物では、ゲノムDNAはヌクレオソーム※2が連なったクロマチンを形成することで核内に収納されている。ヌクレオソームはヒストン複合体にDNAが強固に巻きついた構造で、そのままの構造では修復の妨げになると考えられる。切断されたクロマチン上において、RAD51がどのようにヌクレオソームと結合し、DNA修復を進めるのか、そのメカニズムは不明だった(図1)。
※1 DNA損傷
DNAを構成する塩基の酸化や塩基同士の異常な結合、DNA切断など、ゲノムDNA配列や構造に影響を及ぼすさまざまな損傷。二本鎖切断はDNAの両方の鎖が切断される損傷であり、X線などの電離放射線、環境物質、DNA複製ストレスなどによって生じる。DNA損傷はがんや遺伝病といった重篤な疾患の原因となるため、生物は損傷を正確に修復する仕組みを持っている。
※2 ヌクレオソーム
クロマチンの基本単位であり、4種類のヒストン(H2A、H2B、H3、H4)をそれぞれ2分子ずつ含んだヒストン8量体に、約150塩基対のDNAが巻き付いた構造体。
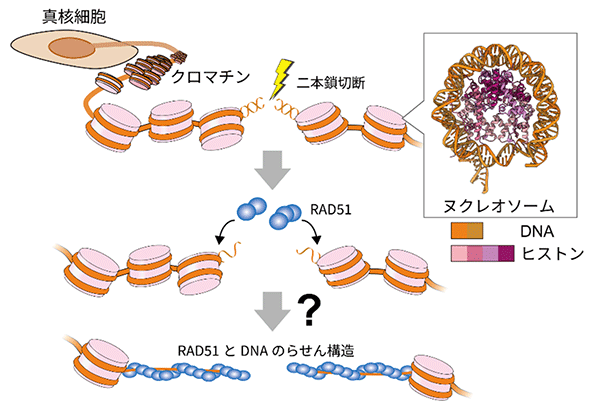
図1 RAD51によるクロマチン上での二本鎖DNA切断修復の謎 ヒトを含む真核生物のゲノムDNAは、ヌクレオソームを基本構造としたクロマチン構造を形成する。ゲノムDNAに二本鎖切断が生じた後、DNA上にRAD51が集積してDNA修復が進行するが、クロマチン上における反応進行のメカニズムは謎だった。
RAD51が段階を経てDNAを修復するプロセスを明らかに
胡桃坂教授らの研究グループは、クライオ電子顕微鏡※3を使って、DNA切断末端を含むヌクレオソームとRAD51の複合体の構造を解析した。その結果、RAD51がリング状構造を形成してヌクレオソームに結合すること、またRAD51がリング状構造でDNA切断末端を認識すること、さらにRAD51がヌクレオソームからDNAを引き剥がしながら、らせん状の構造を形成することが発見された(図2)。これらは、RAD51のクロマチン上への集積、損傷部位への結合、DNA修復の開始という3つの過程に対応していると考えられる(図3)。
一方、RAD51のアミノ末端ドメイン(以下、N末端ドメイン)※4は、クロマチン構造を持つ真核生物にのみ存在する領域で、クロマチン構造を持たない原核生物のRecA(RAD51に相当するタンパク質)には存在せず、その機能は不明だった。本研究により、RAD51のN末端ドメインがヌクレオソームDNAとの結合に重要な機能を果たしていることが明らかになった。この結果から、RAD51のN末端ドメインは、RAD51がクロマチン上に集積して二本鎖切断を修復できるよう、進化の過程で真核生物が獲得したドメインであることが明らかとなった。また、RAD51のリング構造においては、二本鎖切断の修復の活性中心であるL1ループ領域※5を介して、二本鎖切断部位を検知していた(図2b右)。
以上から、クロマチンにおいてDNAが切断されると、RAD51はN末端ドメインを介してヌクレオソームに結合し、リング状構造を形成して切断部位を認識する。さらにRAD51がヌクレオソームからDNAを引き剥がしながららせん状の構造を形成し、DNA修復を開始するというプロセスが今回の研究で明らかとなった。
※3 クライオ電子顕微鏡
タンパク質を含む試料を極低温環境下で凍結し、氷包埋した試料を電子線で観察する顕微鏡。大量の画像を撮影することで、多様な角度情報を持つ粒子像を得ることができ、その情報からタンパク質の立体構造を再構成できる。
※4 RAD51アミノ末端ドメイン(N末端ドメイン)
RAD51のアミノ基のある末端側に存在するドメイン。RAD51は2つの球状ドメインで構成されており、アミノ末端側に存在する球状ドメインとRecAと相同な球状ドメインを有する。
※5 L1ループ領域
RAD51のRecAと相同な球状ドメインに存在する領域で、直鎖状のDNAとの結合に重要であることがわかっている。
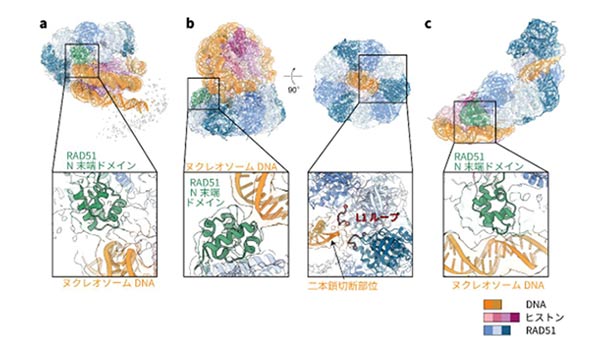
図2 RAD51がヌクレオソームに結合した構造 (a)RAD51がヌクレオソーム上でDNA修復開始の待機をしている様子、(b)RAD51がヌクレオソーム上の二本鎖切断を認識している様子、(c)RAD51がヌクレオソーム上でDNA修復を開始した様子。(b)の構造では、RAD51のL1ループ領域が、二本鎖切断部位と結合していた。
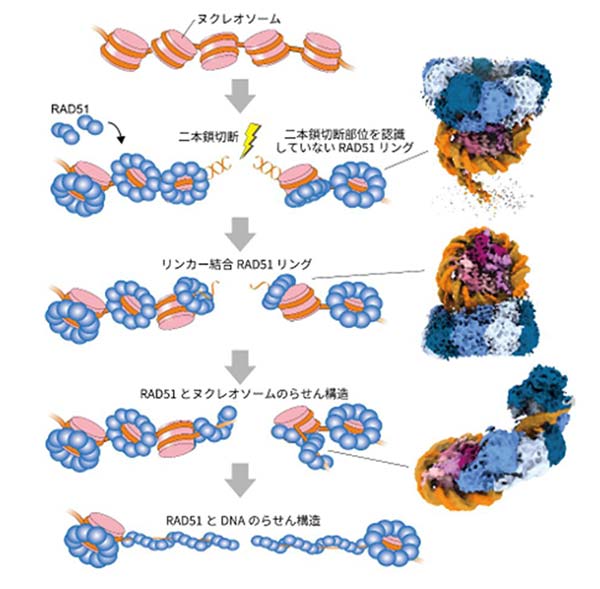
図3 RAD51がクロマチン上でDNAの二本鎖切断を修復するモデル RAD51はクロマチンにリング構造で結合して待機し、さらに二本鎖切断の認識に機能する。その後、RAD51はヌクレオソームからDNAを引き剥がしながららせん構造を形成することで、二本鎖DNA切断の修復を進行する。右列の3つの構造は、図2で示したRAD51とヌクレオソームの複合体の構造に対応している。
がん発症メカニズムの解明、新しい治療法の確立に期待
DNAの修復において、クロマチン結合への重要性が明らかとなったRAD51のN末端ドメイン。このRAD51のN末端ドメインには、多くのがん患者でアミノ酸の変異が見つかっている。本研究成果により、RAD51のN末端ドメインが変異することによって、DNA修復時に、RAD51とヌクレオソームの結合に支障が生じ、発がんの原因になると示唆された。本研究の進展は、今後、RAD51のN末端ドメインの変異を原因とするがん発症のメカニズム解明や、治療法の確立に貢献することが期待される。
また、胡桃坂教授らは、これまでクロマチンアトラスの実態解明に取り組んできており、本研究はその成果のひとつとなるが、まだまだ全貌解明は遠い。将来、クロマチンアトラスの実態が解明されれば、生命の遺伝情報利用の根幹に迫るとともに、関連疾患においては、これまでにない新たな治療法の確立に貢献することが期待される。
- ライフサイエンスの成果一覧へ
- 事業成果Topへ
- English