事業成果
将来の抗老化・がん予防方法開発への貢献が期待
最長寿齧歯類ハダカデバネズミにおける老化細胞死の誘導機構を解明2024年度更新

- 三浦 恭子(熊本大学 大学院生命科学研究部 教授)
- 創発的研究支援事業
- 「長寿齧歯類特有の恒常性維持機構の解明と応用」(2022-最長10年間)
ハダカデバネズミ特有の老化細胞の細胞死を発見
三浦恭子熊本大学大学院生命科学研究部教授・河村佳見助教らの研究グループは、老化耐性・発がん耐性をもつ最長寿齧歯(げっし)類ハダカデバネズミ(図1)の線維芽細胞※1に細胞老化を誘導すると、他の種ではみられない細胞死を起こすことを発見した。さらに、そのメカニズムとして、ハダカデバネズミ特有のセロトニン代謝制御と過酸化水素(H2O2)※2への脆弱性が働いていること、同様のメカニズムが生体内でも生じていることを明らかにした。
ハダカデバネズミの線維芽細胞はさまざまな状況で細胞老化することがわかっていたが、加齢したハダカデバネズミの組織では老化細胞の指標となる遺伝子の発現が低いことから、何らかのメカニズムにより老化細胞の蓄積が抑制されているのではないかと考えられていた。
今回の研究成果により、ハダカデバネズミでは老化細胞が種特異的なセロトニン代謝調節とH2O2への脆弱性によって細胞死を起こし、生体内での老化細胞の蓄積を防ぐことで、本種の老化耐性、ひいてはがん耐性にも寄与している可能性が示された。
さらに研究を進めることで、より安全性の高い老化細胞除去薬の開発につながることが期待される。
※1 線維芽細胞
結合組織を構成する細胞の1つで、コラーゲンなどの細胞外基質を産生し、皮膚組織や臓器の構造維持に寄与する。創傷治癒や組織修復においても重要な役割を担う。
※2 過酸化水素(H2O2)
エネルギー代謝の際に発生する活性酸素の1種。DNAや脂肪酸、生体膜等を酸化し損傷する。

図1 ハダカデバネズミ
アフリカに生息する齧歯類。長寿命、発がん耐性、老化耐性を持つ。
老化耐性・発がん耐性を持つ最長寿齧歯類ハダカデバネズミ
一般に老化細胞は、不可逆的に増殖を停止した細胞で、細胞死を起こしにくく、加齢に伴い体内に蓄積する性質がある。蓄積した老化細胞は、さまざまな炎症性タンパク質などを産生することにより、組織の炎症や老化、がんなどの多様な加齢性疾患の発症を促進することが報告されてきた。
ハダカデバネズミは、アフリカのサバンナの地下に生息する最長寿齧歯類で、顕著な老化耐性と発がん耐性を持つことが知られている。最大寿命は37年以上で、同程度の体格であるマウスの約10倍も長命である。
こうしたハダカデバネズミの老化耐性や発がん耐性について、培養細胞のストレス耐性、DNA修復機構、タンパク質の安定性や翻訳の正確性などが調べられてきたが、ハダカデバネズミの生体が持つ老化耐性のメカニズムについては、ほとんど解明されていなかった。
日本で唯一、ハダカデバネズミを飼育している熊本大学大学院生命科学研究部 老化・健康長寿学講座は、これまでハダカデバネズミの抗老化・発がん耐性の研究を進めてきた。
ハダカデバネズミの線維芽細胞に蓄積するセロトニンが老化細胞死の鍵
三浦教授らの研究グループは、ハダカデバネズミの老化細胞がどのような経過をたどるのかを調べるために、寿命が2~3年と短命で細胞老化および個体老化を起こすマウスと比較、解析した。マウスとハダカデバネズミの線維芽細胞に、低濃度のドキソルビシン(DXR)※3を添加して、細胞老化を誘導した。その結果、マウスにもハダカデバネズミにも細胞老化の特徴が見られたが、ハダカデバネズミの細胞でのみ、アポトーシス※4を含む細胞死が徐々に増加することがわかった(図2)。この細胞死は、細胞老化に重要な役割を果たす遺伝子INK4a※5を人為的に発現させた場合にも起こった。また、この細胞死は、急性のアポトーシス誘導に重要なp53遺伝子※6ではなく、INK4aの下流で脱リン酸化されることで細胞老化を誘導するRB遺伝子※7の活性化を介していることが判明した。
※3 ドキソルビシン(DXR)
抗がん剤の1 種。DNAの塩基対に入り込み、DNAの合成や複製、転写を阻害する。
※4 アポトーシス
プログラムされた細胞死機構の1つ。アポトーシスを起こした細胞は、核や細胞質の断片化が起きるが、細胞膜が保たれているので細胞内の成分が漏れ出さず、炎症誘導能力は低い。
※5 INK4a
サイクリン依存性キナーゼ阻害因子の1つ。細胞周期に重要なサイクリン依存性キナーゼを阻害し、後述するRBを脱リン酸化して細胞周期の停止をもたらす。
※6 p53遺伝子
細胞がストレスやDNA損傷などを受けると活性化するがん抑制遺伝子の1つ。DNA修復や細胞増殖停止、アポトーシスなどを誘導する機能を持つ。
※7 RB遺伝子
がん抑制遺伝子の1つ。細胞周期進行時にはサイクリン依存性キナーゼによりリン酸化され、不活性化しているが、INK4aによりサイクリン依存性キナーゼが阻害されると脱リン酸化し、細胞周期進行に重要なE2Fと結合して阻害し、細胞周期を停止させる。
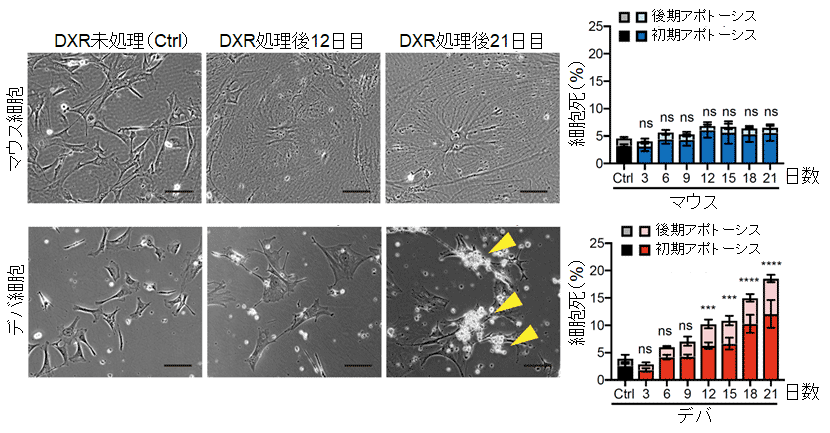
図2 ドキソルビシン(DXR)を用いた細胞老化誘導
(左)マウスとハダカデバネズミの線維芽細胞に、低濃度のドキソルビシン(DXR)を添加して細胞老化を誘導した細胞の写真。黄色矢印は死細胞を示す。
(右)日数が経過するにつれて、ハダカデバネズミの細胞でのみでアポトーシスを含む細胞死が有意に増加した。ns:有意差なし。*:有意差あり。
細胞老化を誘導した際の代謝産物を調べたところ、細胞老化を誘導していないハダカデバネズミの線維芽細胞には、マウスでは見られないセロトニンの蓄積が生じており、細胞老化を誘導した後はセロトニンが減少し、その代謝産物である5-ヒドロキシインドール酢酸(5-HIAA)が増加した(図3左)。
セロトニンは、モノアミン酸化酵素(MAO)により代謝されて、5-HIAAになる際、大量の過酸化水素(H2O2)を生じることが知られている(図3右)。実際、老化したハダカデバネズミ細胞ではマウスとは異なり、モノアミン酸化酵素のタンパク質量が増加していた。
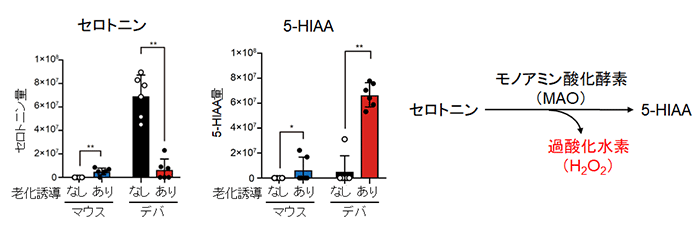
図3 細胞老化誘導前後のセロトニンおよびその代謝産物5-HIAA量の変化
(左)マウスとハダカデバネズミの線維芽細胞に、INK4aを強制発現して細胞老化を誘導し、セロトニンおよび5-HIAA量を解析。細胞老化誘導していないハダカデバネズミ細胞ではセロトニン量が多く、細胞老化誘導後は5-HIAA量が多かった。
(右)セロトニンはモノアミン酸化酵素により代謝されて5-HIAAになる。その際、大量のH2O2が生じる。
ハダカデバネズミはH2O2を水に還元する抗酸化酵素(グルタチオンペルオキシダーゼ)の活性が著しく低く、ハダカデバネズミ線維芽細胞は通常酸素条件での維持が困難であり、マウス線維芽細胞に比べてH2O2に顕著な脆弱性を示すことが知られていた。そのため、老化誘導時で生じるH2O2によって、ハダカデバネズミの細胞死が引き起こされているのではないかと考えられた。
そこで研究グループは、細胞老化を誘導した後、H2O2を含む活性酸素種を抑制する抗酸化剤、もしくはモノアミン酸化酵素阻害剤を添加した。すると、ハダカデバネズミの細胞死が有意に抑制された(図4)。
これらの結果から、老化誘導後のハダカデバネズミ線維芽細胞の細胞死には、モノアミン酸化酵素が重要な役割を果たしていることが判明した。
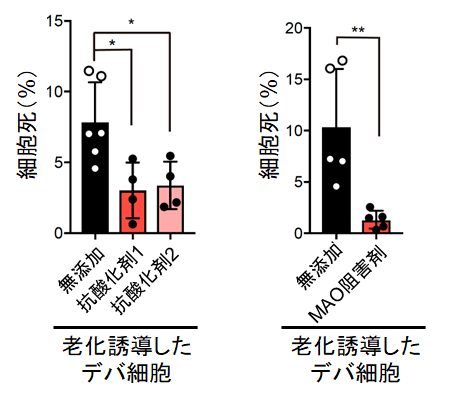
図4 抗酸化剤やモノアミン酸化酵素阻害剤添加により細胞死が抑制
ハダカデバネズミの線維芽細胞に、INK4aを強制発現して細胞老化を誘導し、抗酸化剤またはモノアミン酸化酵素(MAO)阻害剤を添加すると細胞死が抑制された。
研究グループはさらに、ハダカデバネズミの体内でも同様のメカニズムがあるのかを解析するために、DNA傷害剤のブレオマイシン※8をマウスとハダカデバネズミとの肺に投与し、細胞老化を誘導した。その結果、急性の細胞死がマウスとハダカデバネズミの両方で起こったが、21日目に、マウスでは老化細胞の蓄積がみられたが、ハダカデバネズミでは細胞死が有意に増加していた。
さらにモノアミン酸化酵素阻害剤をハダカデバネズミに投与したところ、細胞死が抑制され、細胞老化が増加した(図5)。これらのことから、ハダカデバネズミの肺において、モノアミン酸化酵素のセロトニン代謝による細胞死が、老化細胞の蓄積抑制に関与していると考えられる。
※8 ブレオマイシン: 抗がん剤の1つ。DNAの切断を誘発する。

図5 細胞老化誘導したハダカデバネズミの肺ではモノアミン酸化
酵素阻害剤投与により細胞死が抑制、細胞老化が増加
マウスとハダカデバネズミの肺にブレオマイシンを投与して細胞老化を誘導すると、21日目にハダカデバネズミのみで細胞死が増加した。モノアミン酸化酵素(MAO)阻害剤を添加するとハダカデバネズミで細胞死が抑制され、老化細胞が増加した。
より安全性の高い「senolytic drug(老化細胞除去薬)」開発への貢献が期待
今回の研究成果から、ハダカデバネズミの線維芽細胞に細胞老化を誘導すると他の種では見られない細胞死を起こすこと、またそのメカニズムとして、種特異的なセロトニン代謝調節と過酸化水素(H2O2)への脆弱性が関わっていることがわかった。これはハダカデバネズミの生体内でも起こり、その結果、老化細胞の蓄積抑制に寄与していることが示された。この老化細胞の蓄積を防ぐメカニズムが、ハダカデバネズミの老化耐性、ひいてはがん耐性にも寄与している可能性が考えられる。
近年、老化細胞を除去する「senolytic drug(老化細胞除去薬)」の開発が進められているが、老化細胞は組織修復などの生体の恒常性維持に関わるとの報告もあり、安全な創薬開発のためには安全な老化細胞の除去という観点での研究も必要となる。一方、ハダカデバネズミは進化の過程で、H2O2への脆弱性と、細胞老化時に活性化する「セロトニン代謝スイッチ」を協調させ活用することで、生来的に安全性の高い老化細胞除去のメカニズムを身につけていると考えられる。
今後、ハダカデバネズミの老化細胞を除去するメカニズムの研究を発展させることで、ヒトにおいてどの老化細胞をいつどこで、どのように除去するべきかなど、より安全な「senolytic drug」の開発に貢献することが期待できる。
- ライフサイエンスの成果一覧へ
- 事業成果Topへ
- English