事業成果
従来の進化観を覆す世界初の実証例
大腸菌の昆虫共生細菌への短期間での進化に成功2024年度更新

- 深津 武馬(産業技術総合研究所 生物プロセス研究部門 首席研究員)
- ERATO
- 「深津共生進化機構プロジェクト」研究総括(2019-2024)
大腸菌を昆虫の共生細菌へ進化させることに成功
ERATO深津共生進化機構プロジェクト(以下、本プロジェクト)では、独自に確立した昆虫と大腸菌の共生進化系(昆虫-大腸菌人工共生進化系)を用いて、大腸菌を昆虫にとって必須の共生微生物に進化させることに成功した。具体的には、共生細菌なしでは生きられないチャバネアオカメムシ(以下、カメムシ)から共生細菌を除去し、かわりに高速で進化する大腸菌を感染させて継続的に飼育維持した結果、数カ月から1年ほどの短期間のうちに大腸菌に生じた単一の突然変異※1により、大腸菌がカメムシの生存を支える必須の共生細菌に進化しうることを明らかにした。
※1 突然変異
生物の遺伝情報の担体(多くの場合は遺伝子DNA)に生じる変化のこと。塩基置換、挿入、欠失、逆位、転座などさまざまなものがある。
宿主と微生物の高度な共生関係の成り立ちに迫る
ヒトを含む動植物と微生物の共生関係は、生物機能の獲得や維持や進化に深く関与しており、共生関係なくして生物は存在し得ないといって過言ではないほど、普遍的に重要な役割を担っている。近年、共生に関する研究は国際的に大きな展開を見せているが、従来の研究のほとんどは既存の共生関係を対象としたものであり、共生関係の獲得に至る進化である「共生進化」の現場を実際に観察し、共生関係がどのように始まり成立したのかという問いにアプローチするような研究は極めて限られている。特に、宿主生物の生存に必須であるような微生物との高度な共生関係の進化的起源は、手つかずの重要な研究課題として残されている。
近年、主に微生物を対象として実験室で進化の過程や機構をリアルタイムで明らかにしようという「実験進化学」が興隆しつつある。しかし、宿主生物の生存に必須であるような高度な相利共生※2微生物の進化は、一般的に長い年月をかけて起こるものであり、実験室で人工的に再現して実証することは困難であると考えられてきた。
※2 相利共生
共生関係のうち、関係をもつそれぞれの生物が互いに利益を得ているもの。
カメムシと大腸菌を用いて人工的に共生進化を引き起こす
本プロジェクトでは、高度な相利共生微生物の進化の過程および仕組みを、カメムシと大腸菌を用いた実験進化系により実証することに取り組んだ。研究総括である深津武馬産業技術総合研究所首席研究員らの研究グループは、重要な農業害虫として知られるカメムシ類を含む多様な昆虫類とそれらの共生微生物についての研究を、国際的に先導してきた実績がある。
カメムシの生存には、消化管後部に発達する共生器官※3に保有する共生細菌が必須であり、共生細菌がいない非感染の状態では幼虫の成長が著しく遅れ、ほとんど成虫になれず死滅する。日本各地に分布するカメムシ集団の間で、共生細菌を入れ替えて影響を評価する感染置換実験を実施する中で、カメムシから共生細菌を除去して代わりに大腸菌を摂取させてみたところ、成長は著しく遅れたものの、ごく少数(5~10%程度)ではあるが異常な体色を示す小さな成虫が羽化してきた。大腸菌は本来、ヒトを含む哺乳類の腸内に生息する細菌であり、カメムシとは共生関係にないはずであるが、カメムシに共生して生存を支える最低限の能力を持つことが判明した(図1)。
※3 共生器官
共生微生物を保有するために特殊化した宿主生物の器官のこと。カメムシの場合、盲嚢と呼ばれる袋状の構造が消化管後部に多数配列し、その内部に共生細菌を保有する。
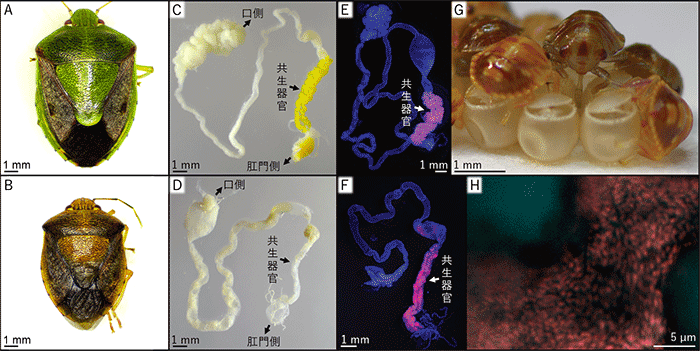
図1 共生細菌に感染したカメムシ(上)と大腸菌を感染させたカメムシ(下)
(A,B)それぞれの細菌に感染したカメムシの羽化成虫。体色・体サイズが大きく異なることがわかる。
(C-F)消化管後部が共生器官となっており、黄色く見える盲嚢部の中に共生細菌を保有する。大腸菌を摂取させた場合、共生器官の発達は悪く無色であるが、大腸菌の局在は同様に観察される。
(G,H)母虫は共生細菌を卵の表面に塗布し、孵化した幼虫は卵表面を吸うことで共生細菌を獲得する。大腸菌を感染させた母虫の産んだ卵表面にも大腸菌は塗布されていた。
本プロジェクトでは、大腸菌をカメムシに感染させて継続的に植え継ぐことで、本来の共生細菌的な性質を実験室で進化させようと考えた。しかし、単純に大腸菌をカメムシに感染させたところで、共生進化が簡単に起こるとは期待しがたい。そこで、DNA修復酵素を破壊することで遺伝子の突然変異率を高め、分子進化速度※4を通常の100倍程度に加速させた「高速進化大腸菌※5」を用いることにした。この高速進化大腸菌をカメムシの無菌幼虫に摂取させて、「成長速度」と「羽化成虫の体色」それぞれに選択をかけた実験進化系列を多数作成し、宿主カメムシ10世代以上に相当する約2年間にわたり、感染、飼育、維持を継続した(図2)。
※4 分子進化速度
遺伝子が進化する速さのこと。突然変異率が高くなると比例して分子進化速度が上昇する。
※5 高速進化大腸菌
突然変異の蓄積率が高くなるように遺伝学的に操作を加えることで、分子進化速度を加速した大腸菌のこと。本研究では、DNAミスマッチ修復酵素遺伝子mutSを欠失させた大腸菌系統を用いた。
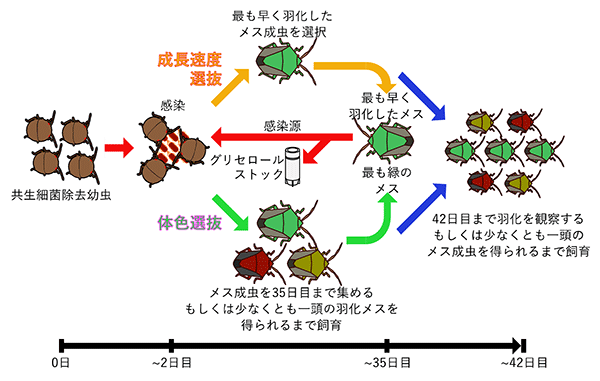
図2 共生進化実験のデザイン
成長速度による選択では最も早く羽化した成虫を、体色による選択では最も緑色が強い成虫をそれぞれ選抜し、その共生器官を摘出して内部の大腸菌を次世代の無菌幼虫に摂取させた。
その結果、成虫体色による選抜では約1年(7世代目)、成長速度による選抜ではなんと2カ月後(2世代目)から、羽化率の顕著な上昇(30~80%)を示す進化系列が出現した。これらの系列では羽化率の上昇に伴ってカメムシの体色が緑色に近づき、体サイズも大きくなるなど、本来の共生細菌を保有する正常なカメムシの形質に近づくような傾向を示した(図3)。

図3 高速進化大腸菌に感染したカメムシの外観および大腸菌のコロニー形状の変化
さらに、宿主のカメムシだけでなく、大腸菌の側にもさまざまな変化が確認された。本来の共生細菌のように宿主の生存や体色を改善するようになった進化大腸菌系列では、細胞外基質の産生の低下、増殖速度の低下、細胞サイズの小型化、運動性の喪失などの顕著な特徴が観察された。
そこで、次世代シーケンサー※6を用いて全ゲノム配列を決定・比較して、共生進化に伴って大腸菌のゲノム上に出現した突然変異を網羅的に解析した。その結果、進化大腸菌の体色選抜系列・成長速度選抜系列のそれぞれにおいて、炭素カタボライト抑制※7に関与する広域転写制御系※8の遺伝子の機能喪失突然変異が候補として同定された。これらの遺伝子の変異が共生進化の原因であることを確かめるために、野生型の大腸菌にこれらの遺伝子の突然変異を導入したところ、カメムシ内で共生進化した大腸菌と同様に、細胞外基質の産生の低下、増殖速度の低下、細胞サイズの小型化、運動性の喪失などが観察された(図4)。さらに、これらの大腸菌をカメムシの無菌幼虫に摂取させたところ、羽化率の向上や体色の緑化が再現された。すなわち、炭素カタボライト抑制が機能しなくなり、グルコースが枯渇した状態でも代謝の切り替えが起こらなくなるような突然変異が生じることで、大腸菌がカメムシの生存や体色を改善するようになることが示された。
これらの結果により、従来の常識を覆し、宿主生物の生存に必須な相利共生細菌の進化が迅速かつ容易に起こりうること、そして大腸菌のゲノムにたった1つの突然変異が入るだけでカメムシの生存を支える必須共生細菌になり得ることが明らかになった。
※6 次世代シーケンサー
DNAの塩基配列を決定するための装置であり、1回の解析で数千万~数十億塩基対におよぶ膨大な塩基配列情報を得ることができる。
※7 炭素カタボライト抑制
大腸菌をはじめとする細菌類においてみられる広域転写制御系の1つであり、グルコースなどの代謝されやすい炭素源があるときに、それを消費するまで代謝されにくい炭素源の分解系の遺伝子発現を抑制する機構。
※8 広域転写制御系
同一の調節遺伝子が多数の遺伝子群の発現や機能を制御している場合、そのような調節遺伝子を広域転写因子、システム全体を広域転写制御系という。
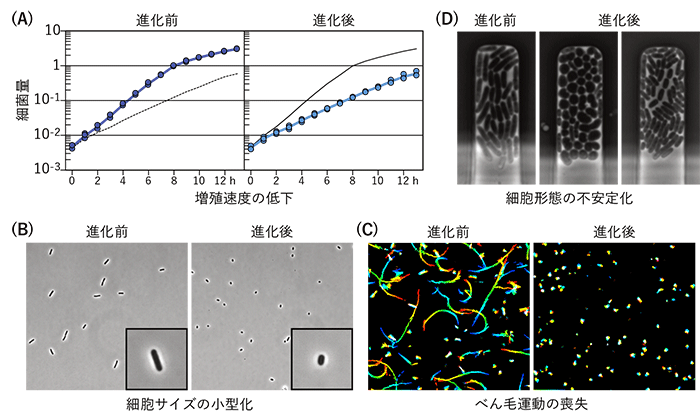
図4 共生進化の前後における高速進化大腸菌の変化
生物に広く共通する共生機構の解明へ
本プロジェクトが確立した昆虫-大腸菌人工共生進化系を用いることで、これまで長らく未解明であった共生進化の過程や機構に関する理解が飛躍的に進展することが期待される。また、本プロジェクトは昆虫に加えて、無菌マウスも宿主に加えた相互の共生進化系にも取り組んでいる。そのようなアプローチを通じて、無脊椎動物から脊椎動物に至る腸内共生機構の相違点および共通点を解明することで、将来的には腸内細菌の制御による医療や健康維持への貢献も期待できる。
- ライフサイエンスの成果一覧へ
- 事業成果Topへ
- English