事業成果
RNA修飾の原理解明と応用研究への挑戦
tRNA修飾の新たな機能の発見と生物学的な役割の解明2024年度更新

- 鈴木 勉(東京大学 大学院工学研究科 教授)
- ERATO
- 「鈴木RNA 修飾生命機能プロジェクト」研究総括(2020-2025)
東京大学の鈴木勉教授の研究グループはRNA修飾研究の新たな地平を開拓している。特にRNAの可逆的なリン酸化修飾の発見や、tRNAの糖付加修飾酵素の研究で世界をリードする成果を発信した。
可逆的なRNAのリン酸化修飾が生物の耐熱性に寄与する
タンパク質や生体内のさまざまなメタボライト(アミノ酸や有機酸、脂肪酸、糖類等の内因性代謝物)の機能や、その代謝が、リン酸化と脱リン酸化によってダイナミックに調節されていることは、生化学や分子生物学の基本的な概念として知られているが、RNAのリン酸化修飾は見過ごされていた。鈴木勉教授の研究グループは、好熱性アーキア(古細菌)やバクテリアの転移RNA(tRNA)に可逆的なリン酸化修飾が生じていることを世界で初めて発見した。この修飾は、tRNAに耐熱性やRNA分解酵素に対する耐性を与え、生物の耐熱性に寄与することが明らかになった。
tRNAリン酸化修飾の発見
tRNAは、タンパク質合成(翻訳)の過程でmRNA上の遺伝暗号(コドン)とアミノ酸を対応させるアダプター分子として機能する。tRNAは転写後に多様な化学修飾を受けることで機能的に成熟する。これらの修飾は、tRNAの立体構造の安定化や、コドン解読の正確性に寄与している。そのため、tRNA修飾の欠損や異常は遺伝子発現の破綻を招き、生育不良や疾患の原因となる。タンパク質のリン酸化修飾は、細胞内の情報伝達において重要な調節機構であることがよく知られているが、RNAのリン酸化修飾の機能は解明されていなかった。
研究グループは、超好熱性アーキアSulfurisphaera tokodaiiから複数種類のtRNAを単離精製し、質量分析および、生化学的な手法で解析したところ、tRNAの可変ループ内の47位に、ウリジン(U)の2’位がリン酸化された新規RNA修飾、2’リン酸化ウリジン(Up)を発見した(図1A)。Up修飾を持つtRNAと、脱リン酸化したtRNAの熱融解温度(Tm値)を比較したところ、Up修飾を持つtRNAは、Tm値で6.6℃も融点が高いことが判明した。また、Up修飾はtRNAを分解酵素から保護する役割があることも判明した。さらに、X線結晶構造解析(図1A)から、Up修飾は、tRNAのコア構造の柔軟性を維持し、準安定な構造をとることでtRNAの熱変性を食い止める、言わば南京錠のような働きをしていることが判明した。これはRNA修飾によるRNAの安定化機構として全く新しい概念である。
RNAリン酸化修飾による耐熱性と可逆性
研究グループは、好熱性のアーキアやバクテリアから、Up修飾を導入する酵素、すなわちtRNAをリン酸化修飾する酵素ArkIを発見した(図1B)。好熱性アーキアでarkI遺伝子を破壊すると高温での生育が低下したことから、tRNAのUp修飾は生物の耐熱性に寄与することが判明した。さらに、研究グループはUp修飾を取り除く脱リン酸化酵素KptAを同定し、細胞内でUp修飾が可逆的に起こることを見いだした(図1B)。この結果は、タンパク質と同様に、tRNAも可逆的なリン酸化による機能調節を受けているという、エピトランスクリプトミックな遺伝子発現調節機構の存在を示唆している。好熱性細菌のような極限環境生物において、Up修飾の可逆性は、tRNA構造の柔軟性を素早く変化させることで、急激な生育温度の変化などに速やかに対応する生存戦略であることを示唆している。
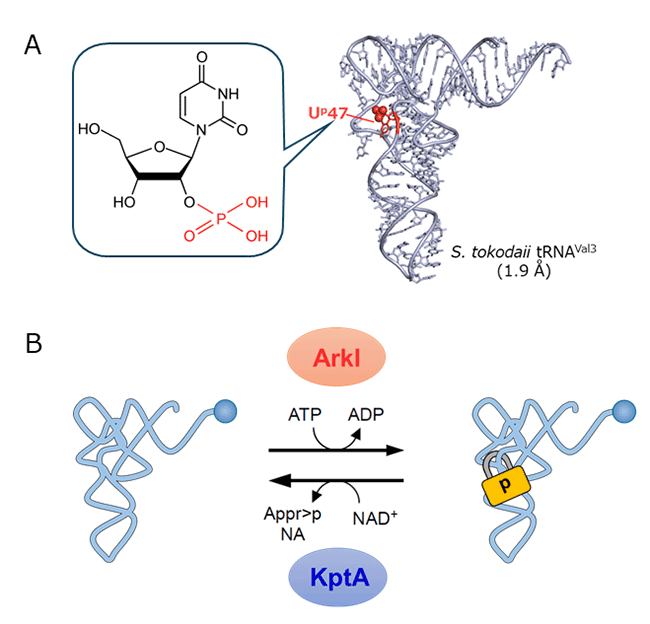
図1 好熱性アーキアtRNAに見いだされた2’リン酸化ウリジン修飾とその可逆性(Ohira T, et al., Nature, 2022)
(A) 2′リン酸化ウリジン(Up)修飾の化学構造およびS. tokodaii tRNAVal3のX線結晶構造(解像度1.9 Å)。Up修飾を赤で示す。(B) ArkIとKptAによる可逆的なtRNAのリン酸化。
tRNAの糖付加修飾が翻訳速度を調節する
tRNAにはさまざまな化学修飾が含まれ、これらはタンパク質合成(翻訳)を行うために重要な役割を担う。最近の研究から、tRNA修飾は細胞内代謝物の量的な変化や環境ストレスに応じて動的に変化すること、tRNA修飾の欠損や異常が、ミトコンドリア疾患、神経障害、がんに関与していることが明らかになってきた。
キューオシン(Q)(図2)は、7デアザプリン骨格およびシクロペンテン環を持ったグアノシン誘導体で、細菌からヒトに至る多くの生物に見られるtRNA修飾である。ヒトや脊椎動物は、Qの塩基部分であるキューイン(q)を生合成できないため、腸内細菌が合成したqや、食物から栄養素としてqを摂取することで、tRNAのQ修飾に利用する(図2)。ヒトや脊椎動物は、4種類の細胞質tRNAがQ修飾を持っているが、このうちチロシン(Tyr)に対応するtRNATyrは、Q修飾にさらにガラクトースが付加されたガラクトシルキューオシン(galQ)を持ち、アスパラギン酸(Asp)に対応するtRNAAspは、Q修飾にはマンノースが付加したマンノシルキューオシン(manQ)に変換される(図2)。これらの糖付加Q修飾は1976年に西村暹(すすむ)博士らにより発見されたが、その生合成や機能は約半世紀もの間、謎に包まれていた。
キューオシン糖付加酵素の発見と機能
研究グループは、ラットおよびブタの肝臓抽出液から、硫安分画や多段階のクロマトグラフィー法を用いて、酵素活性の追跡から、二種類の糖付加Q修飾酵素を発見した。Q修飾にガラクトースを転移する酵素をQTGALと命名し、マンノースを転移する酵素をQTMANと命名した(図2)。
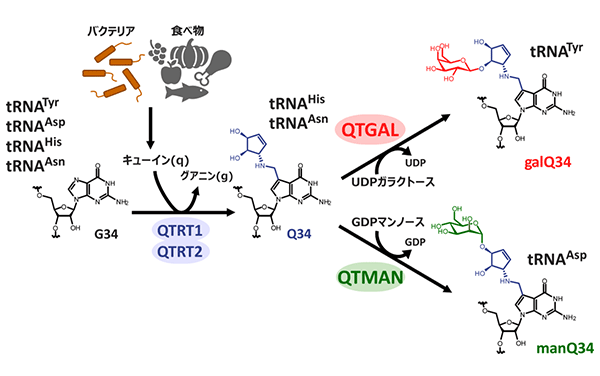
図2 キューオシン(Q)および糖付加Qの生合成(Zhao X, et al., Cell, 2023)
次に、リボソームプロファイリングによって翻訳速度を計測したところ、QTGALノックアウト(KO)細胞では、tRNATyrが読むUACコドンの翻訳速度が速くなり、QTMAN KO細胞ではtRNAAspが読むGACとGAUコドンの翻訳速度が速くなることが判明した。これらのことから、Qの糖付加修飾はコドン特異的に翻訳速度を制御する役割があることが明らかとなった。
クライオ電子顕微鏡を用いたリボソームとtRNA複合体の構造解析(図3A)から、Q修飾のシクロペンテン環は水素結合を介してコドン―アンチコドン対合が形成する二重らせんの主溝に結合し、コドンの認識効率を上げていることが明らかとなった(図3B)。一方、Qの糖付加は、シクロペンテン環を回転させることでこの効果を弱めることが判明した(図3CD)。これらの構造生物学的な知見は、糖付加Q修飾が翻訳速度を調節するメカニズムをうまく説明している。
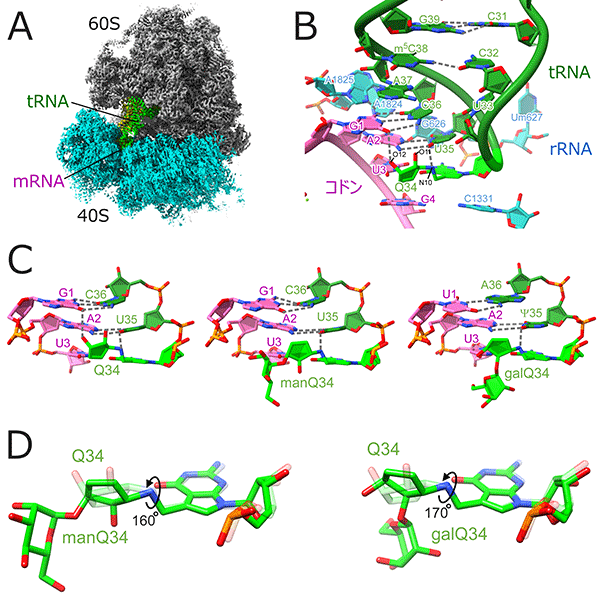
図3 糖付加Q修飾はコドン-アンチコドン対合の主溝に結合する(Zhao X, et al., Cell,
2023)
(A)ヒトリボソーム、mRNA,tRNAの複合体のCryoEM構造、(B)mRNAのコドンとtRNAのアンチコドンの対合、(C)Q修飾、manQ修飾、galQ修飾それぞれの認識様式、(D)マンノースとガラクトースの付加によるシクロペンテン環の回転
適切な翻訳速度の調節は新生タンパク質の正しい折りたたみ(フォールディング)と健全なプロテオスタシスに必要である。実際に、QTGAL KO細胞やQTMAN KO細胞では、新生タンパク質が凝集しやすくなることが判明し、糖付加Q修飾がプロテオスタシス維持に重要な役割があることが明らかとなった(図4)。
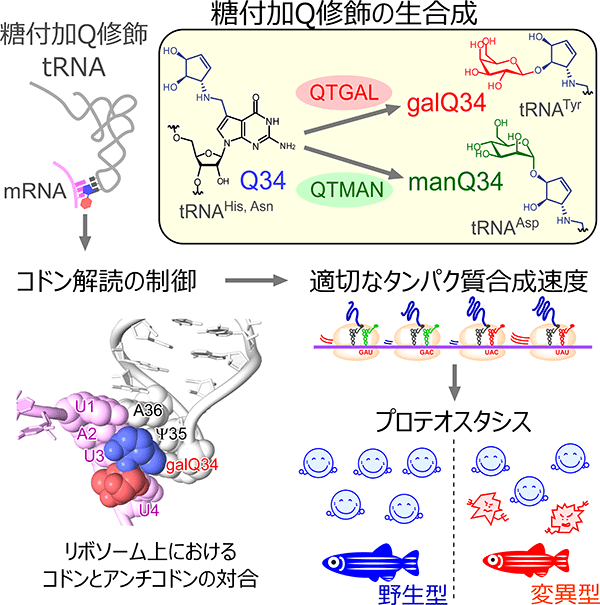
図4 tRNAの糖付加Q修飾が適切な翻訳速度を調節し、正常なプロテオスタシスを保つ(Zhao X, et al., Cell, 2023)
ゼブラフィッシュによる糖付加Q修飾の機能解析
ゼブラフィッシュを用いて、qtgalとqtmanのKO系統を作成した。これらの変異体は正常に胚発生するが、野生型と比較して生後の成長速度が顕著に遅く、体長が短い表現型を示した(図4)。さらに、qtgal KO系統では、翻訳開始因子eIF2αのリン酸化が顕著に亢進することが判明した。これは、適切な翻訳速度が乱れたためタンパク質のフォールディング異常が検知され、統合的ストレス応答が作動したことを示唆している。これらのことから、糖付加Q修飾はゼブラフィッシュの健全な生育に必要であることが判明した。
tRNA修飾のRNA医薬への応用に期待
RNAは医薬開発における新しいモダリティとして注目されている。特にmRNAワクチンやsiRNA、アプタマーなどに代表される核酸医薬が次々と実用化されている。RNA修飾は細胞内におけるRNA医薬の安定性や自然免疫の回避などの重要な機能が知られており、本プロジェクトで得られた成果は、将来的にRNA医薬に応用されることが期待される。
- ライフサイエンスの成果一覧へ
- 事業成果Topへ
- English