事業成果
地球環境にやさしいバイオプラスチックの生産へ
プラスチック原料を生成するラン藻の代謝メカニズムを探求2023年度更新

- 小山内 崇(明治大学 農学部 専任准教授)
- 先端的低炭素化技術開発(ALCA)
- 実用技術化プロジェクト「革新的な細胞制御法や育種法による高効率バイオ生産の技術開発」
「ラン藻の発酵代謝工学-光合成を基盤としたコハク酸・乳酸生産」研究開発代表者(2013-2022)
ラン藻を用いたジカルボン酸生産の最高記録を達成
研究チームは以前に、ラン藻の一種(シネコシスティス※1)を発酵させることで、細胞内のグリコーゲンがバイオプラスチック※2の原料となるコハク酸や乳酸などの化合物に変換されることを発見した。研究を続けた結果、「遺伝子改変」と「発酵法の工夫」によって、ラン藻からのバイオプラスチック原料の生産量を向上させることに成功した。ラン藻のグリコーゲンからコハク酸を生産する前段階の反応を触媒する酵素=リンゴ酸デヒドロゲナーゼ(MDH)の遺伝子を改変した株(CitHox株)を作製して発酵させることで、細胞外に放出されるコハク酸を含むジカルボン酸※3(フマル酸、リンゴ酸)の量が増えることを確認した。またコハク酸の生産を抑制する要因が、「生成されたコハク酸そのもの」と「培地の酸性化」であることを解明。生産抑制を避ける手法を開発し、ラン藻を用いたジカルボン酸生産の最高記録を達成した。
さらに研究を進める中で、バイオプラスチックの増産につながるラン藻の遺伝子の発現を大規模に改変・制御する可能性を切り拓く「ラン藻の転写調節を担うシグマ因子とプロモータの関係の解明」も行った。細胞がエネルギーをつくる基本的な代謝であるクエン酸回路※4を利用した有用物資の生産につながる研究にも取り組み、リンゴ酸がオキサロ酸ではなくビルビン酸に変換される特殊なクエン酸回路を発見した。
※1 シネコシスティス(Synechocystis)
ラン藻(原核生物であり、酸素を発生する光合成を行う)の一種。1996年に、ラン藻としては初めて全ゲノム配列が決定された。増殖が速く、遺伝子改変が容易で、凍結保存が可能であるなどの利点を有する。そのため、モデルラン藻として、ラン藻の基礎研究・応用研究の両分野で広く利用されている。
※2 バイオプラスチック
植物などの再生可能な有機資源を原料とするバイオマスプラスチックと、生分解性プラスチック(微生物などの働きで二酸化炭素と水にまで分解する)の総称。
※3 ジカルボン酸
コハク酸、リンゴ酸、フマル酸など、2つのカルボキシル基(-COOH)を持つ化合物はジカルボン酸と呼ばれている。ジカルボン酸は、バイオプラスチックをはじめとした有用な化学工業原料となることが多い。
※4 クエン酸回路
生物が、クエン酸を次々とさまざまな物質に変換しながら、その過程で還元力を生産するための経路。クエン酸回路で生成した還元力は、呼吸によってATPを生産することができる。アミノ酸などを合成するための基質を供給する回路でもある。
社会から求められる環境負荷の小さいプラスチック
幅広い工業製品に使われている便利なプラスチックだが、海洋プラスチック汚染をはじめ、さまざまな環境問題を引き起こしている。また原料となる石油の枯渇も懸念され、使用量の削減が社会課題となっている。そのため近年では、化石燃料でなく植物などの再生可能な資源を原料とするバイオプラスチックの研究が活発に行われている。
ラン藻(シネコシスティス)は、光合成を行う細菌であり、空気中のCO2をグリコーゲンとして蓄えて、代謝反応(発酵)により、バイオプラスチックの原料となるコハク酸や乳酸をはじめ、さまざまな物資を合成することが知られている。しかし、求める物資の生産ができるよう、ラン藻の細胞を制御する技術や、代謝反応(発酵)に使われる酵素の性質などの解明は進んでいない。
ラン藻の炭素代謝メカニズムを解明
ラン藻(シネコシスティス)を使ったバイオプラスチック原料の生産増を目指す研究チームは、リンゴ酸デヒドロゲナーゼ(MDH、遺伝子名citH)に着目した。そして、シネコシスティスの細胞内で、遺伝子を改変(リンゴ酸デヒドロゲナーゼ遺伝子citHを強く発現)させたCitHox株を作製した。次に、野生株(遺伝子改変をしていない株)とCitHox株を培養し、「遺伝子改変の効果」を調べるために、細胞量を少なくして発酵を行わせて、バイオプラスチック原料となるジカルボン酸(コハク酸、フマル酸、リンゴ酸)が、CitHox株では野生株よりも多いことを明らかにした(図1)。
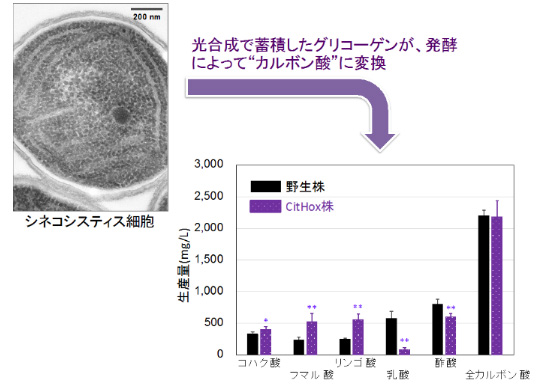
図1 シネコシスティスにおけるグリコーゲンからカルボン酸への変換
シネコシスティスは、光合成でグリコーゲンを貯めることができる。左図はグリコーゲンが50%程度蓄積したシネコシスティス細胞。この蓄積されたグリコーゲンは、発酵によってカルボン酸に変換される。細胞外に放出されたカルボン酸の量(黒が野生株、紫がCitHox株)。右図は、6回の実験データの平均と標準偏差の値を示したグラフ。(*P<0.05,**P<0.005)
さらに、ジカルボン酸の生産量増加に取り組み、発酵に使う細胞量を増やした高密度条件でのラン藻の発酵を行った。細胞量を10倍にして発酵を行うと、生産されるジカルボン酸の量は増えたが、10倍までにはならなかった。このため、高密度にすると何らかの要因でジカルボン酸の生産が阻害されていることが示唆された。
研究チームは、ジカルボン酸の生産の阻害要因として、2つの可能性を考え、①「生成された物質(ジカルボン酸)自体が、途中の反応を妨害する」、②「培地の酸性化による溶液中の炭素化合物のイオン化状態が変化するため、ジカルボン酸の生産量が低下する」ことを確認した。そこで、生産量の阻害要因を取り除くべく、発酵中に培地を新しくする「ストリッピング法」(図2)を開発して実験を行い、これまで知られているラン藻からのジカルボン酸生産の最高記録を達成した(4日間で生産されたコハク酸、フマル酸、リンゴ酸の合計は、それぞれ4.2 g/L, 2.7 g/L, 4.6 g/L)。
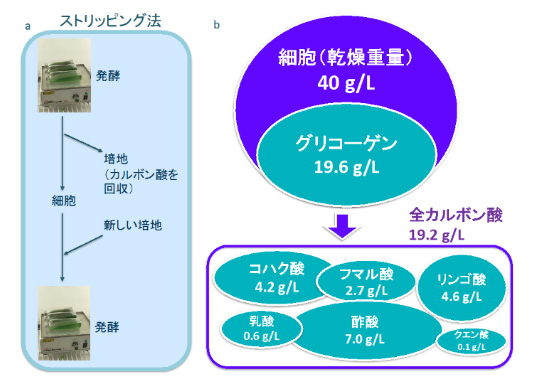
図2 ストリッピング法を用いたカルボン酸生産
また研究チームでは、ラン藻(シネコシスティス)がグリコーゲンを分解する経路を利用して、バイオプラスチック原料となる有機酸を生産させる過程で重要な役割をもつ遺伝子改変に関する研究を進めた。シネコシスティスでは、糖の分解を行う酵素を発現させるために代替シグマ因子※5SigEが働く。研究チームは、シネコシスティスのゲノム上で、SigEがどこに結合しているかを調べるためのクロマチン免疫沈降シーケンス(ChIP-seq)(図3)実験を実施した。その結果、ラン藻の糖分解とバイオプラスチック生産に関与する代替シグマ因子SigEのゲノム上の結合箇所を特定できた。
※5 シグマ因子
生物は環境が変化すると転写する遺伝子を変えて対応する。原核生物では、シグマ因子と呼ばれるタンパク質が、転写する遺伝子を選択する。複数種類のシグマ因子を使い分けることで、環境変化に対応した遺伝子を働かせる。シグマ因子は、遺伝子のプロモータ領域のDNA配列に結合することで転写する遺伝子を選択する。生存に必須な遺伝子群(ハウスキーピング遺伝子)の転写は、主要シグマ因子と呼ばれるシグマ因子が担い、環境変化に応答する遺伝子群は代替シグマ因子と呼ばれるシグマ因子が転写する。
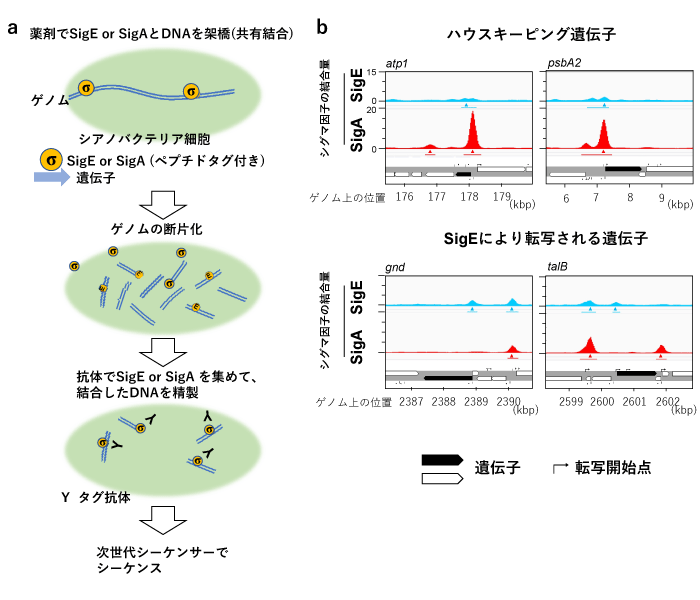
図3
(a)ChIP-seq法の概略図。
(b)ChIP-seq法で分かったSigEおよびSigAの結合場所。横軸はシネコシスティスゲノム上の位置。縦軸はSigEまたはSigAのゲノム領域に対する結合強度。
さらに研究チームでは、ラン藻(シネコシスティス)のクエン酸回路の解明にも取り組んだ。生命活動と物質生産の両方で重要な代謝経路であるクエン酸回路は、酵素反応によって代謝産物を酸化していく過程で、NADH※6というエネルギーを持つ物質を生成する。一般的にクエン酸回路の中で、リンゴ酸は、リンゴ酸脱水素酵素(MDH)の働きによって、オキサロ酢酸へと変換される。しかしラン藻では、リンゴ酸脱水素酵素の活性が低く、リンゴ酸がどのように変換されているのか不明瞭であった。またラン藻は、リンゴ酸をピルビン酸に変換するマリックエンザイム(ME)という別のリンゴ酸変換酵素をもっているが、この酵素がリンゴ酸脱水素酵素の代わりにクエン酸回路でどんな働きをしているかはわかっていなかった。研究チームの解析により、ラン藻のクエン酸回路ではMDHではなくMEがリンゴ酸を変換していること、リンゴ酸はオキサロ酢酸ではなくピルビン酸に変換されていることが明らかになった(図4)。
※6 NADH
ニコチンアミドアデニンジヌクレオチド。真核生物・原核生物を問わず、酵素の酸化還元反応において、電子を供与する還元剤として働く。
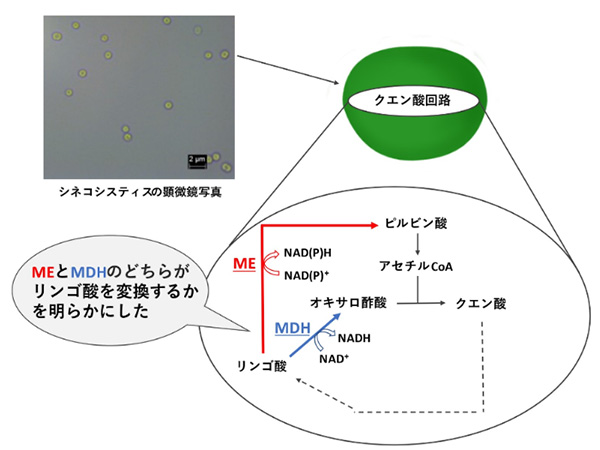
図4 MEとMDHによるリンゴ酸の変換
バイオプラスチックの原料生産の実用化へ
研究チームは、ラン藻の「遺伝子改変」と「発酵法の改良」により、世界最高レベルでのジカルボン酸生産に成功した。研究をさらに進めることで、二酸化炭素を利用したバイオプラスチックの原料生産の実用化が進むものと見込まれる。
遺伝子改変へのアプローチは、シネコシスティスによる物質生産の基礎となる知見の獲得につながる。ラン藻にはシネコシスティス以外にも、さまざまな物質生産上の利点を持つ生物種がいるため、それらの遺伝子改変による物質生産においても役立つ知見となると期待される。また、シネコシスティスのクエン酸回路の酵素反応の研究成果も、さまざまな生物のクエン酸回路に関わる酵素反応の理解につながる。
小山内准教授は、シアノバクテリアの研究活動を通した気付きをきっかけに、微細藻類を用いて脱炭素などを目指す研究者を支援する明治大学発ベンチャー「株式会社シアノロジー」を設立した。同社は設立後、多くの製品やサービスの販売に成功した。また、上場企業や明治大学と契約を結び、明治大学とは新株予約権を対価に知的財産権に関する契約を締結した。大学発ベンチャーの新たな成功事例となることが期待される。
- ライフサイエンスの成果一覧へ
- 事業成果Topへ
- English