事業成果
小型化・低コストを実現した次世代診断法
新型コロナウイルスの世界最速検出装置を開発2023年度更新

- 渡邉 力也(理化学研究所 主任研究員)
- CREST
- 「細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出」領域・「細胞外微粒子の1粒子解析技術の開発を基盤とした高次生命科学の新展開」研究代表者 (2019-2025)
世界最速、「SATORI法」を超える次世代診断法
今回、渡邉力也理化学研究所主任研究員らの研究グループは、新型コロナウイルス(SARS-CoV-2)由来のウイルスRNA※1を「1分子」レベルで識別し、迅速に検出できる全自動検出装置「automated platform on SATORI:opn-SATORI」の開発に成功した(図1)。
これは2021年に、同グループが開発した世界最速のSARS-CoV-2検出法「SATORI法」を基盤とし、感度・精度を大幅に向上させたものだ。opn-SATORIは、9分以内に検体中のウイルスRNA個数を全自動で定量できる。検出感度はPCR検査法と同等で、COVID-19の診断に十分な感度を持つ。臨床検体を用いた検証実験では、陽性判定および変異株判定で98パーセント以上の正解率を誇る。しかもランニングコストは1検査当たり2ドル程度と、PCR検査法や抗原検査法と同等程度だ。
※1 ウイルスRNA
RNAはリボ核酸。ウイルスは、とても小さな粒子の中に、自己増殖のための遺伝情報を持つ。その遺伝情報を伝えるのがDNAやRNAである。

図1 opn-SATORI 装置
サンプルの調製、顕微鏡測定、ウイルスの個数定量、陽性/変異株判定のすべてを自動化することに成功した。
従来のSATORI法の課題に挑む
新型コロナウイルス感染症(COVID-19)の感染診断の現状は、主にタンパク質抗原を検出する方法(抗原検査法)と、ウイルスRNAを増幅して検出する方法(PCR検査法※2)が利用されている。2つの方法はそれぞれスクリーニング、確定診断など、用途に応じて使い分けられる。感染が疑われる場合、抗原検査法を用いたスクリーニングを実施。抗原検査法は30分程度と迅速かつ簡便にウイルスを検出できるため、スクリーニングには適している。しかし、検出感度や検出エラーの多さが問題となっていた。
一方、スクリーニングの後の確定診断として用いられているPCR検査法では、専門的な技術や装置を用いて検体からRNAを精製。さらに増幅の過程を経てウイルスを検出する。感度が高く、確定診断に適しているが、検出の前処理に最短で1時間程度かかること、また、増幅に起因する検出エラーも発生することから、大量の検体を迅速に解析し、診断につなげることが難しい。
そうしたことから、PCR検査法の「感度の高さ」、抗原検査法の「迅速・簡便さ」を両立させた新しいウイルス検出法の開発が待ち望まれていた。
そこで2021年、研究グループは、世界最速の新型コロナウイルスの検出法「SATORI法」を開発した。SATORI法は理学と工学の先進技術を融合させたもので、検体中の標的ウイルスRNAの有無を短時間に判定できる革新性を持っていた(図2)。
しかしSATORI法の検出感度はPCR検査法より低く、また変異株の判定ができないなどの課題があった。さらに実用化を想定すると、臨床現場での効率的な運用には、感染診断プロセスの全自動化が必要不可欠だ。そのためSATORI法の要素技術の改善、ならびに全自動化装置の開発が期待されていた。
※2 PCR検査法
ポリメラーゼ連鎖反応法(polymerase chain reaction)を用いて、生物の遺伝子を増幅させ、検出可能な量まで増やして検出する方法。
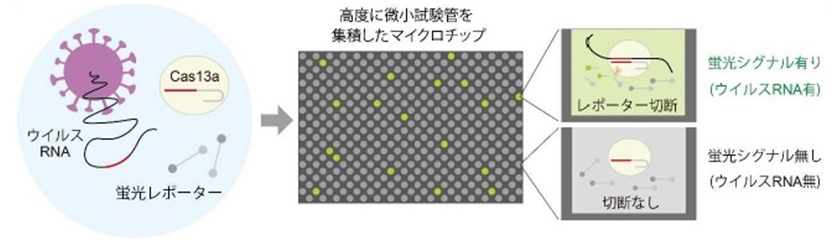
図2 独自の新型コロナウイルスの世界最速検出技術(SATORI 法)
核酸切断酵素Cas13aと蛍光レポーター、検体のウイルスRNAを混ぜると、ウイルスRNAとCas13aの複合体が形成される。複合体が形成されると Cas13aの酵素活性がオンとなり、蛍光レポーターが切断される。これをマイクロチップアレイに小分けにして封入すると、ウイルスRNAが存在する試験管だけ蛍光シグナルが1分以内に上昇する。マイクロチップの蛍光シグナルの有無を二値化し、そのデジタル信号からシグナル有りの試験管の個数をカウントする。試験管内にウイルスRNAは1個だけ存在するため、カウントされる試験管の個数は、サンプル中のウイルスRNAの個数に相当する。
高速・高感度に加え、低コストの自動検出装置を目指す
研究グループは、従来のSATORI法の要素技術を徹底的に改善した。COVID-19感染診断検査のうち、サンプルの調製、顕微鏡測定、ウイルスの個数定量、陽性/変異株判定といった、すべての工程を全自動化するopn-SATORI装置の開発に成功した。opn-SATORI装置は、9分以内でウイルスRNAを1個ずつ識別し、検体中の個数を全自動で定量することができる(図3)。検出感度は1.4コピー/マイクロリットル(1,000分の1mL)で、従来のSATORI法の1,400倍に達する。この感度はPCR検査法と同等で、COVID-19の診断には十分だ。
加えて、変異株に特徴的な1塩基※3単位の変異を識別する技術も併せて開発。陽性判定とともに、オミクロン株などの既知の変異株の判定が可能になった。COVID-19臨床検体を用いた検証実験では、陽性判定、変異株判定で98%以上の正解率を達成している(図4)。
opn-SATORI装置のランニングコストは1検査当たり約2ドルで、PCR検査法や抗原検査法とほぼ同等。安価で素早く多種のウイルス感染症を正確に診断できる次世代の感染症診断装置となることが期待できる。
※3 塩基
RNA(リボ核酸)やDNA(デオキシリボ核酸)を構成する主要な成分。
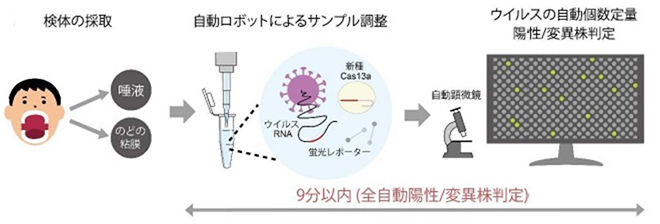
図3 opn-SATORI装置による全自動COVID-19感染診断
感染診断の模式図。サンプル調製、顕微鏡観察、ウイルスの個数定量、陽性/変異株判定のすべての工程が自動化され、9分以内で完結できる。
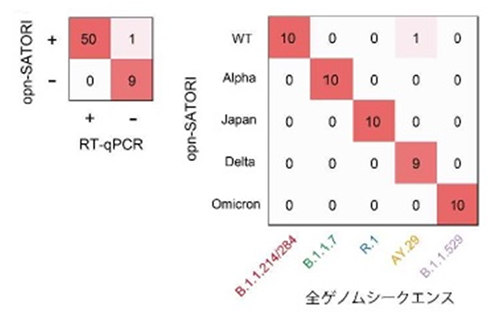
図4 COVID-19臨床検体を用いた検証実験
臨床検体を用いた陽性判定(右)、変異株判定(左)結果。ともに正解率98%以上である。
迅速かつ幅広い疾患を診断する次世代の基盤技術へ
opn-SATORI装置は、今後2つの方向性を目指している。1つは利用シーンの拡大、もう1つは機能の伸張である。
利用シーンの拡大として、研究グループではその後「opn-SATORI装置」の検出部を大幅に改善した安価な小型装置「COWFISH(Compact Wide-field Femtoliter-chamber Imaging System for High-speed digital bioanalysis)」を開発した。COWFISHは、従来のopn-SATORI装置と比較して、設置面積比で約5分の1以下まで小型化。また約30分の1以下まで低コスト化することに成功した。さらに、最短3分の迅速検出を実現。SARS-CoV-2の検出感度は、opn-SATORI装置とほぼ同等であり、臨床検体を用いた実証実験では、陽性判定において95%の正解率を達成している。
COWFISHは小型化・低コスト化したことで、大規模検査センターだけでなく、市中のクリニックや検疫所に設置され、臨床現場即時検査(POCT)を実施する基盤装置となる可能性も広がっている(図5)。
もう1つの機能面の伸張として、opn-SATORI装置はSARS-CoV-2だけでなく、疾患バイオマーカーの検出などにも活用できる。今後はがんなどの基礎疾患の早期・層別化診断などを目指す、次世代のリキッドバイオプシー※4の技術基盤としての活躍も注目されている(図6)。
※4 リキッドバイオプシー
血液や尿など、身体への負担が少ない液性検体の解析を基盤とした、基礎疾患・感染症の診断方法。

図5 小型化・低コスト化したCOWFISH
検出時間の大幅な短縮を実現し、安価で素早く多種のウイルス感染症を正確に診断できる。
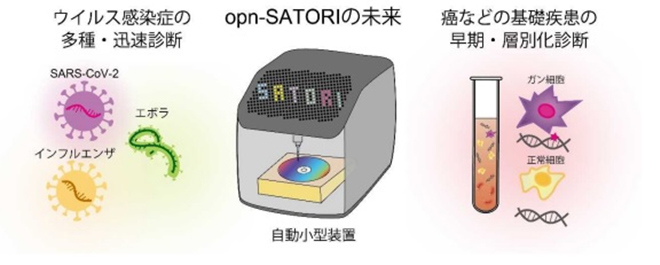
図6 リキッドバイオプシーとしてのSATORI法の将来展望
多種のウイルス感染症の迅速診断から、がんなどの基礎疾患の早期・層別化診断まで。SATORI法の次世代リキッドバイオプシーとしてのイメージ。
- ライフサイエンスの成果一覧へ
- 事業成果Topへ
- English