事業成果
感染症やがんの診断技術としても注目
超高感度、世界最速で新型コロナウイルスを検出2022年度更新

- 渡邉 力也(理化学研究所 開拓研究本部 渡邉分子生理学研究室 主任研究員)
- CREST
- 細胞外微粒子領域「細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出」領域・「細胞外微粒子の1粒子解析技術の開発を基盤とした高次生命科学の新展開」研究代表者(2019-2025)
世界最速の検出法「SATORI法」を開発
新型コロナウイルスの感染が拡大し、日本国内でも感染者が増え続ける日が続いた。そのさなかに問題となったのは、新型コロナウイルス(SARS-CoV-2)の感染診断に、時間と手間と費用がかかることだった。
今回、渡邉力也主任研究員らの共同研究グループは、理学と工学の異分野融合研究を推進。SARS-CoV-2由来のウイルスRNA(リボ核酸)を「1分子」レベルで識別して、5分以内に検出できる革新的技術の開発に成功した。今回の成果は、世界最速※1の新型コロナウイルス検出法で、「CRISPR-based amplification-free digital RNA detection;SATORI法」と命名された。
SATORI法は従来のPCR検査のように核酸を増幅させないため、エラーが少なく、5分以内に新型コロナウイルスRNAを1個ずつ識別して検出できる。また、検出感度は5フェムトモーラー※2で、新型コロナウイルス感染者の検体中のウイルスRNA量を高感度で検出可能。しかも、ランニングコストは9ドル程度と安価だ。
本研究成果は、新型コロナウイルス感染症(COVID-19)などの超高感度・迅速診断装置の開発を含む、次世代の感染症診断法の核心技術として、応用展開に期待が集まる。
※1 2021年7月現在
※2 フェムトモーラー
「fM」と表記。1fMは1000兆分の1[10-15]モーラー。モーラーとはモル濃度のことで、濃度を表す方式の1つ。溶液1 L中の溶質をモル数で表したもので、単位は[mol/L]
待ち望まれていた新しい検出法
現状の新型コロナウイルス感染診断では、主にタンパク質抗原を検出する方法(抗原検査)と、ウイルスRNAを増幅して検出する方法(PCR検査)※3が利用されている。この2つはそれぞれスクリーニングや確定診断など、用途に応じて使い分けされている。
感染が疑われる場合は、抗原検査を用いたスクリーニングを実施。抗原検査は、結果判明まで30分程度と迅速、かつ簡便にウイルスを検出できるため、スクリーニングには適している。ただし、検出感度の低さなどによる検出エラーの多さが問題となっている。
一方、スクリーニングの次の確定診断として用いられるPCR検査では、専門的な技術や装置を用いて、検体からRNAを精製。さらに増幅の過程を経て、ウイルスを検出する。PCR検査は感度が優れ、確定診断に適している。しかし、検出の前処理に最短で1時間程度がかかること、また増幅に起因する検出エラーも発生する。そのため大量の検体を迅速に解析し、診断することは困難だ。こうした状況下で、PCR検査の「感度の高さ」と、抗原検査の「迅速・簡便さ」を両立させる新しいウイルス検出法の開発が急がれていた。
※3 PCR法
PCR(polymerase chain reaction)法は、ポリメラーゼ連鎖反応法のこと。生物の遺伝子を増幅させ、検出可能な量まで増やしていく方法。

図1 これまでの新型コロナウイルス感染症の診断法
手早くできる抗原検査はスクリーニングとして用いられ、正確性の高いPCR検査で診断が確定される
迅速・高感度で、しかも大量解析が可能なSATORI法
SATORI法は、渡邉主任研究員グループが専門とする「マイクロチップを利用した酵素反応の1分子検出技術※4」と、東京大学の西増弘志・濡木理グループが専門とする「核酸切断酵素CRISPR-Cas13a(Cas13a)※5」に関する先進技術を融合させたものだ。特定のRNA配列を認識する「Cas13a」と、蛍光レポーター※6の混合液をバイオセンサーとして利用し、検体中の標的となるウイルスRNAの有無を高感度・高精度、しかも迅速に検出する。
※4 マイクロチップ技術
半導体製造プロセスを活用して、微細構造をチップ上に造形する技術。本研究では、容積3フェムトリットルという世界最小レベルの微小試験管を、約100万個集積したマイクロチップを造形した。
※5 核酸切断酵素CRISPR-Cas13a
多くの細菌は、異物が体内へ侵入した際に獲得される「CRISPR-Casシステム」と呼ばれる獲得免疫システムを持っている。同じ異物が再度体内へ侵入した際は、前回の記憶でこの免疫の仕組みが働き、その異物が除去される。CRISPR-Cas13aはCRISPR-Casの1つで、ガイドRNAと複合体を形成すると活性化。標的となるRNAを切断する。
※6 蛍光レポーター
標的RNAとCas13aの複合体を検出するための蛍光性の機能分子。この分子は、5塩基のオリゴRNAから構成され、その5'、3'末端がそれぞれ蛍光基と消光基で標識されている。通常、蛍光は消光しているが、標的RNAによって活性化されたCas13aによって、オリゴRNAが切断されると、蛍光基と消光基が物理的に解離し、結果として、蛍光シグナルが得られる。
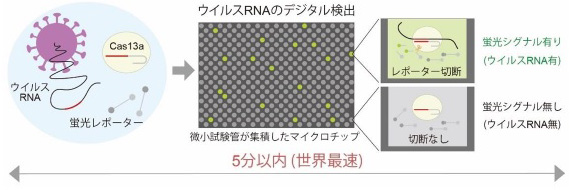
図2 SATORI法によるウイルスRNAのデジタル検出原理
理学と工学のコラボで、超高感度で世界最速のシステムが開発された
1)核酸切断酵素 Cas13aと蛍光レポーターの混合液に、ウイルスRNAを混ぜる。するとウイルスRNAとCas13aの複合体が形成される。
2)複合体が形成されるとCas13aの酵素活性がオンとなり、蛍光基と消光基がつながった蛍光レポーターが切断される。
3)3フェムトリットル(fL、1f Lは1000兆分の1リットル)の微小試験管が100万個集積されたマイクロチップアレイに、(2)の複合体と蛍光レポーターの混合液を小分けにして封入。Cas13aの切断活性で、ウイルスRNAが存在する試験管だけ、蛍光シグナルが1分以内に大きく上昇。
4)蛍光シグナルの有無を確認し、そのデジタル信号からシグナル有の微小試験管の個数をカウント。カウントされる試験管の個数が検体中のウイルスRNAの個数に相当する。試験管のサイズは、大腸菌とほぼ同じ大きさ。ウイルスRNAを1分子レベルで判別・検出できる。
SATORI法を用いれば、5分以内にウイルスRNAを1個ずつ識別して検出できる(図3a)。検出感度は、5フェムトモーラー※2。これはウイルスRNAの量で表すと、1マイクロリットル(μL、1μLは100万分の1リットル)あたり約103個となる(図3b)。この感度は従来の抗原検査法(104~105個/μL)と比較すると10~100倍高く、PCR検査(10~102個/μL)と比較すると10~100倍低いということになる。
ただし、SARS-CoV-2感染者の検体中のウイルスRNA量は、103~106個/μLである。そのことからSATORI法は、SARS-CoV-2の感染診断を実施する上で必要な感度を満たしているのが分かる。
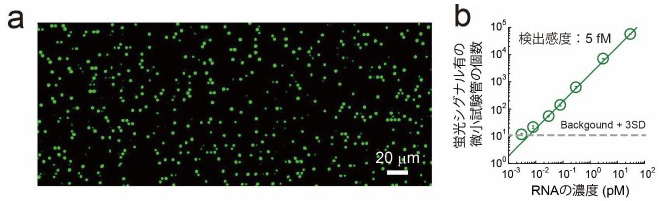
図3 SATORI法によるデジタル検出例
(a)SATORI法でのマイクロチップの蛍光画像。個々の輝点が1分子のウイルスRNAに相当する
(b)ウイルスRNAの濃度と、蛍光シグナルが確認された微小試験管の個数の相関関係。検出感度は5 fM。これをウイルスRNAの量にすると3×103個/μLで、十分な感度である
次世代の感染症診断法や基礎疾患の早期診断へ
SATORI法は、ウイルスRNAを世界最高速度で検出できる革新的技術である。また、SATORI法のランニングコストはおよそ9ドルで、PCR検査の5ドル程度とほぼ同等。今後は安価で、素早く多種のウイルス感染症を正確に診断できる、次世代の感染症診断法となることが期待される(図4)。
さらにSATORI法への期待は、それだけではない。SATORI法は、疾患バイオマーカーの検出などにも活用可能だ。その機能を活かして、がんなどの基礎疾患の早期・層別化診断などを目指す、次世代のリキッドバイオプシー※7の技術基盤となることにも注目が集まる(図4)。
本研究成果は特許出願済みであり、今後は実用化を希望する企業との研究開発を進めていく予定だ。
※7 リキッドバイオプシー
血液や尿など、身体への負担が少ない液性検体の解析を基盤とした、基礎疾患・感染症の診断方法。
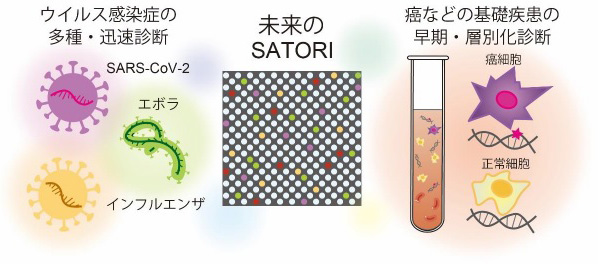
図4 リキッドバイオプシーとしてのSATORI法の将来展望
多種のウイルス感染症の迅速診断から、がんなどの基礎疾患の早期・層別化診断まで。SATORI法の次世代リキッドバイオプシーとしてのイメージ
- ライフサイエンスの成果一覧へ
- 事業成果Topへ
- English