事業成果
環境にやさしい産業技術を目指して
融合研究により広がる酵素利用2017年度更新

- 浅野 泰久(富山県立大学 工学部・生物工学研究センター 教授)
- ERATO
- 生体分子の形と機能
「浅野酵素活性分子プロジェクト 」研究総括(H23-29)
私たちの生活を支える酵素
「酵素」とインターネットで検索するとたくさんの情報が引っかかってくる。洗剤に入っていたり、酵素サプリもあったりと身の周りで沢山使われているようだが、意外と知られていないことも多い。生物学や化学を少し学んだ方なら「酵素はたんぱく質でアミノ酸が繋がってできている」「物質を他の物質へ変換する化学反応を常温・常圧で触媒する」「生物には沢山の種類の酵素がある」ということをご存知かもしれない。酵素を用いた反応は、一般に、金属などを触媒として用いる反応に比べて、効率が良く、有害物質の排出が少ない。さらに温度やpHなども生体内のような穏やかな条件で行える。このため、酵素を用いた物質生産は環境にやさしい技術として注目され、化学工業の分野で実用化が進められている。このような酵素の利用をさらに拡大していくためには、安定で活性の高い酵素の開発が求められている。
JSTの「戦略的創造研究推進事業総括実施型研究(ERATO)」の研究総括である浅野泰久教授は、環境に負荷をかけない物質生産の道を広げるため、多様な酵素を利用した有用物質の生産技術を確立するプロジェクトに取り組み、新たな有用酵素の発見や酵素利用技術の確立など、多方面からアプローチしている。
注目されなかった動物から高性能酵素を発見
浅野教授の取り組みの特長の一つが、研究例が多い微生物や植物だけでなく、取り扱いが困難なこともあり産業用酵素の資源として注目されてこなかった動物をも対象としている点である。近年、新たな酵素を探索する際には、すでに知られている酵素のゲノム配列を用いてある程度の当たりをつけることが多い。その理由は、ゲノム配列に頼らず動植物から新たな酵素をみつけるためには、大量の試料から抽出液を調製し、酵素活性をしらみつぶしに調べるという地道な作業が必要となるからだ。しかし、浅野教授は、最近行われている探索には限界があり、根源的な探索手法によらないと、新しい有用酵素を発見できないと考えた。
浅野教授は長年、窒素を含む化合物を作り出す酵素の研究を行ってきた。中でも医農薬品などの合成材料であるシアノヒドリン化合物の生産に利用されている「ヒドロキシニトリルリアーゼ(HNL)」は、浅野教授にとって親しみのある酵素だ。産業応用されているアーモンド由来のHNLなどは植物に見つかっている酵素であり、その多くは浅野教授の研究で発見された。一方で、動物由来のHNLの存在は知られていなかった。浅野教授は動物に未開拓の酵素遺伝子が眠っていると考え、動物由来のHNLの探索を始めた。HNLは、産業上は青酸とアルデヒドからシアノヒドリン化合物を合成するため使われているが、自然界では、逆の反応であるシアノヒドリン化合物を青酸とアルデヒド化合物に分解する反応を触媒し、植物や動物が外敵に対する防御手段として利用している(図1)。そこで、目をつけたのが節足動物ヤスデだ(図2)。外敵を脅かすために青酸を吹きかけるヤスデが、HNLを持つのではないかと考えた。
しかし、ヤスデがHNLを持っていることを突き止めるためには、ヤスデから青酸を作り出す酵素を取り出す必要があり、そのためには多量のヤスデを集めなくてはならない。汽車を止めるほどのヤスデの大群が10年弱ごとに一度、限られた地域で大発生する話は、以前から本で読んで知っており、そのような機会にぜひ巡り会いたいと思っていた。そんな時に、浅野教授のもとにヤスデが大発生したという知らせが届いた。駆除を行っている自治体に接触したところ、採集の許可がおりたため、大発生地域で、大量のヤスデを集めることができた。集めた大量のヤスデを乳鉢ですりつぶし、酵素を精製するのは手間のかかる作業であったが、最終的に得られた酵素をヤスデ由来のHNLと特定することができた。さらにアミノ酸配列を用いて、遺伝子も特定した。ヤスデ由来のHNLを詳細に調べたところ、既知のHNLよりも5~300倍の非常に高い酵素活性を持つことも分かり、現在使用されている植物由来の酵素に代わって化学工業の現場で産業利用されることが期待されている。
さらに、このヤスデ由来のHNLは、従来知られているHNLとはかなり異なるアミノ酸配列を持つことが明らかとなり、他の生物のHNLとは遺伝的な起源が異なることが、高い酵素活性をもたらしていると考えられた。これまで注目されていなかった動物にも、広く有効利用できる酵素が存在している可能性を示す貴重な例だ。この研究成果から、さまざまな動物が産業用酵素の遺伝子資源としてターゲットになり得ること、それらの酵素は既知の遺伝子配列からだけでは見つからない可能性があることが見えてきた。
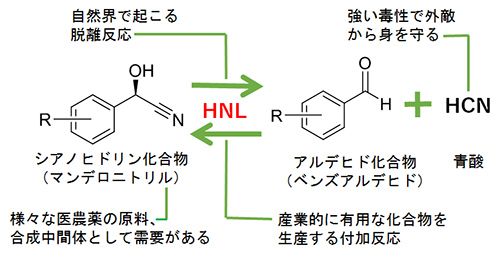
図1 ヒドロキシニトリルリアーゼ

図2 ヤンバルトサカヤスデ
酵素利用のボトルネック解決に向けて
発見した有用な酵素を実用化するには、たんぱく質である酵素を合成し、大量生産をする必要がある。その合成の方法はいくつかあるが、浅野教授は遺伝子組み換え発現系を使用した。合成したい酵素の遺伝子を大腸菌や酵母菌などの宿主細胞に導入し、細胞内で大量に合成させる方法である。しかし、遺伝子組み換えによって合成されたたんぱく質は、かなりの割合で酵素活性をもたない不溶性の沈殿物になってしまうというボトルネックがあった。たんぱく質を産業利用するには可溶性の状態での発現が必要である。可溶化発現の方法としては宿主の変更や宿主の培養条件の検討、遺伝子にランダムに変異を導入し可溶性発現する変異体を探索する方法(ランダム変異導入法)、他の可溶性たんぱく質との融合などが行われているが、試行錯誤を必要とし時間とコストがかかることが課題となっていた。そこで浅野教授は遺伝子の変異により不溶性が可溶性に変わる事例を多数集めて解析し(図3)、不溶性の酵素が可溶性に変わる法則を見出した。またこの情報に基づき、たんぱく質のどのアミノ酸をどのように変化させると本来の酵素の性質を変えずに可溶化できるかを予測する方法を開発した(図4)。本手法は、コンピュータープログラム上でも可溶化の条件を検討できるため、時間もお金も節約できるという画期的な方法である。また、テストしたたんぱく質の約半数が可溶化に成功しており、更に可溶化の打率を上げることを目指している。特許も出願しており、今後の展開が期待される。
図3 植物 (キャッサバ)由来のHNLへの変異導入による大腸菌での可溶性発現
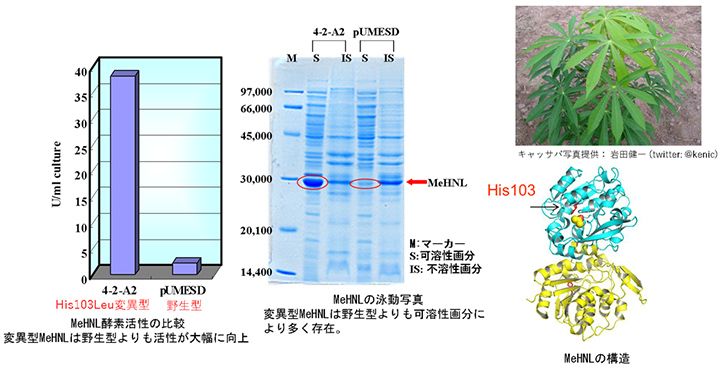
キャッサバ由来のHNLに変異を導入し、遺伝子組み換え発現系での可溶性発現に成功した例。可溶性の獲得につながる変異情報を多数蓄積し法則性を見出したことにより、可溶性発現のための変異箇所の予測が可能になった。
図4 変異部位予測による可溶性発現技術の開発
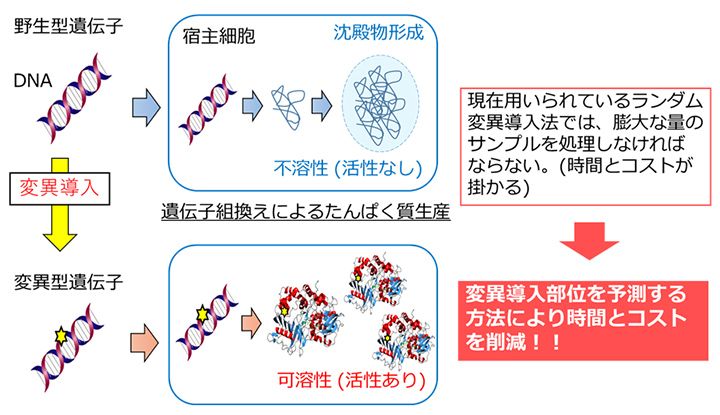
可溶性の獲得につながる変異導入部位の予測により従来のランダムな変異導入法の問題点であった時間とコストの問題を解決することが可能になる。
酵素利用の新たなる展開に向けて
浅野教授はヤスデの研究が注目を集めたため、「最近はヤスデの先生になってしまった」と苦笑している。しかし、浅野教授の目指すところは物質生産も含む「酵素利用の新展開」だ。
酵素の用途は抗生物質、医薬品、食品などの物質生産以外にも幅広くある。例えば病気など、人の体の異変を検査するときにも、酵素が使える。人は病気になると、疾患によって体内の特定アミノ酸の濃度が大きく変動する。つまり血中や尿中のアミノ酸の量がどれぐらいなのか、簡便な方法で精度高く測ることができれば、正確な健診が簡単にできるようになる。現在用いられている多くの装置・試薬の難点は高価であることだが、もし酵素を利用できればこの課題を解決できる可能性がある。
自然界には様々な生き物がいる。それらの特性を理解し、有用な酵素を探索し続けることと、情報分野や生物工学を活用したたんぱく質の改変技術の開発を融合させることで酵素利用の幅広い展開が可能になると期待している。