基礎生物学研究所 植物環境応答研究部門の森田(寺尾) 美代 教授と西村 岳志 助教、中村 守貴 特任研究員、福建農林大学の古谷 将彦 教授、東京大学の平野 良憲 助教は、奈良先端科学技術大学院大学の箱嶋 敏雄 教授、基礎生物学研究所/生命創成探究センターの加藤 輝 特任助教、立命館大学の深尾 陽一郎 准教授らとの共同研究により、シロイヌナズナを用いて重力感受細胞において重力方向の情報伝達に関わる新しい因子RLDを発見しました。
植物の根は地中に向かって、茎は空に向かって成長します。これは植物が重力の方向を感じ取って行う重力屈性と呼ばれる反応です。重力の方向は根や茎の重力感受細胞と呼ばれる特別な細胞で感知されることや、重力方向に反応した植物の屈性がオーキシンの輸送の制御によって行われることなどが知られていますが、重力感受細胞内での重力方向の情報伝達の仕組みの詳細は不明でした。森田教授らの研究グループはこれまでに、LZYと呼ばれるタンパク質が重力屈性に必要であることを明らかにしてきました。今回、LZYと相互作用するタンパク質としてRLDを新たに発見し、RLDもまた重力屈性に関与する重要な因子であること、およびRLDがオーキシン輸送の制御に関わることを明らかにしました。そして、LZYが重力の方向に応答して重力感受細胞内での居場所を変化させ、その時にRLDを結合して同じ場所に連れてくることで、オーキシン輸送を制御するという分子機構を提唱しました。
本研究の成果は、2020年1月3日(英国時間)に国際学術誌「Nature Communications」に掲載されました。
本研究成果は、科学技術振興機構 戦略的創造研究推進事業 CREST「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」研究領域、内閣府の最先端・次世代研究開発支援プログラム、科学研究費補助金である新学術領域研究「植物構造オプト」および「発生ロジック」の支援を受けて行われました。
<研究背景>
植物の根は地中に向かって、茎は空に向かって成長します。これは、植物が重力の方向を感じ取り、根を水分や栄養分が豊富な地中へ、地上部を光合成や生殖に有利な上方へと体の各器官を配置する重要な環境応答の1つで、重力屈性と呼ばれます。
屈性において器官が屈曲する仕組みは、植物ホルモンであるオーキシンが器官内で偏って分布することで引き起こされます。根が重力方向に伸長しているとき、地上部方向から中心部を通って輸送されてきたオーキシンは根端部の根冠で均等に分配されますが(図1上左)、根が傾いて重力方向が変化すると重力側により多くのオーキシンが分配されると考えられています(図1上右)。オーキシン濃度が高くなると根の細胞伸長が抑制されるので、伸長領域で根が屈曲します(図1下)。このような器官内でのオーキシンの分配は、オーキシン排出輸送体PINタンパク質が細胞内で偏りを持って配置されることで制御しています。
さらに根や茎などの器官には、重力方向の変化(器官の傾き)を受容する重力感受細胞があります。この細胞に含まれる色素体はデンプンを高度に蓄積してアミロプラストとなり、細胞質よりも比重が高く重力方向に沈降します。これが重力方向の認識に重要であることが知られています。根の重力感受細胞は、根冠内に位置するコルメラ細胞です(図1下)。コルメラ細胞は、重力方向の変化を受容して重力側にオーキシンをより多く輸送する役割を担っていると考えられています。しかし、重力感受細胞内での重力情報伝達の仕組みは明らかにされていませんでした。研究グループはこれまで、モデル植物であるシロイヌナズナを用いて、植物特有の遺伝子LZY(LAZY1-LIKE)ファミリーが、重力感受細胞内で重力刺激に応じたオーキシンの分布の制御に関与することを明らかにしていましたが、重力感受細胞内で具体的にどのような反応を担うのかは不明でした。
<研究成果>
研究グループはまず、LZYタンパク質と相互作用する因子を同定し、類似した構造を持つタンパク質をRLD(RCC1-like domain protein)1~4と名付けその機能を解析しました。RLD1とRLD4は根の重力感受細胞で働いていること、rld1 rld4二重変異体は重力屈性が弱く、側根の伸長方向が水平方向に近づくこと、さらに重力に応答したオーキシン輸送に異常を示すことを明らかにしました(図2)。これによってRLDがLZYと同じ細胞で同様の役割を担っていることが分かりました。また、rld1 rld2 rld3 rld4四重変異体を用いた解析から、RLDはPINタンパク質の制御を行うことでオーキシン輸送を調節する機能を持つことが分かりました。
LZYとRLDは相互作用しますが、それぞれのC末端に位置するCCLドメインとBRXドメインとの間で相互作用することを明らかにしました。この結合はこれらのタンパク質が細胞内のどこに存在するかを決める重要な働きをしていました。培養細胞中で、LZYは細胞膜、RLDは細胞質と、お互い別々の場所に存在していました。しかしLZYとRLDを同じ細胞で発現させると、RLDはLZYとともに細胞膜に局在することが分かりました(図3)。また、共に細胞膜に局在するためには、CCLドメインとBRXドメイン間での相互作用が必須であることを見いだしました。さらに、その相互作用を担うCCL-BRX複合体について高純度のタンパク質複合体を精製して1000条件以上の結晶化条件スクリーニングを行った結果、結晶が得られました(図4左)。また、大型放射光施設(SPring-8、フォトンファクトリー)でタンパク質結晶にX線を照射して得られた回折データを基にX線結晶構造解析を行い、複合体の3次元構造を決定することにも成功しました。BRXドメインの構造は今までに報告がなく今回が初めてとなります。BRXドメインはコンパクトな形をしていて、CCLのβヘアピン構造という特徴的な構造を認識していることが明らかになりました。さらにBRXとCCLは分子間βシートを形成することで強く結合する仕組みが原子レベルで明らかにされました(図4右)。この構造情報を基に、相互作用を阻害すると予想される点変異をLZYもしくはRLDに導入したところ、両タンパク質間の相互作用が失われるとともに、LZYの存在下でもRLDは細胞質に留まり、また重力感受細胞での機能を失うことが分かりました。つまり、LZYがRLDを細胞膜に連れてくるという性質が、重力感受細胞での機能に重要であることが分かりました。
研究グループは、LZYとRLDが重力感受細胞内でどのように働いているのかについて、解析を進めました。LZYは植物体内でのタンパク質量が非常に低く保たれているため観察が極めて困難でしたが、観察のための形質転換体を慎重に選抜し、固定した側根を透明化することで、重力感受細胞であるコルメラ細胞で微量のLZYタンパク質を捉えることができました。興味深いことに、LZYは重力側の細胞膜に偏って存在しており、180度ひっくり返して重力刺激を与えたところ30分後に新たな重力側の細胞膜にその局在が変化することを見いだしました(図5)。この時、アミロプラストも既に新たな重力側に沈降していることが分かりました。RLDは通常はコルメラ細胞内でほぼ細胞質に存在していますが、同様に重力刺激を与えると60分後に新たな重力側の細胞膜にも存在するようになりました。この現象はlzy変異体背景では観察されませんでした。一方、LZYが重力側に偏って存在する現象はrld変異体背景でも観察されました。また、コルメラ細胞で働くPIN3タンパク質の根冠における分布を調べたところ、野生型では重力刺激後5時間後には重力側に偏って分布していたものの、rld1 rld4変異体ではその偏りがかなり失われていることが分かりました。さらに、人工的に重力感受細胞でのLZYの発現量を増加させてやると、LZYは細胞膜全体に一様に存在するようになり、そのような状況ではRLDも細胞膜全体に一様に存在することが分かりました。この時、側根の伸長方向は分散してしまったことから、LZYタンパク質の量が適度に調節され、重力側への偏在が保たれることが重力屈性にとって重要であることが分かりました。
以上の結果から研究グループは、側根コルメラ細胞では、①アミロプラストの位置情報に基づいてLZYが重力側の細胞膜に偏りを持って局在する、②CCL―BRX間の相互作用によりRLDが細胞質から重力側の細胞膜に移動する、③RLDによる制御がPIN蛋白質の重力側への偏りを生じさせ、④オーキシンを重力側により多く輸送する、という重力シグナル伝達機構を提唱しました(図6)。
<今後の展望>
重力屈性は側枝や側根の伸長角度制御にも関与し、植物器官の空間配置によるプラントアーキテクチャ(植物構造:いわゆる枝振り、根の張り)をつかさどる要因の1つで、育種上重要な形質です。農業的に重要な形質であるものの、その分子メカニズムの理解は進んでいませんでした。今回、RLDの発見とLZYとの機能的関連性の解析を通して、アミロプラスト沈降以降どのように重力側に情報を伝達するのか、具体的な分子機構の一端が明らかとなりました。本研究で得られた成果は、重力屈性における重力情報伝達の分子機構の理解を大きく前進させるものです。研究グループの森田教授は「今後はLZYが重力側の細胞膜に偏って存在する仕組みをさらに追究し、植物の重力方向認識機構の解明に迫っていきたいと考えています。また、RLDによるPINの調節機構についてさらに詳しく解析することで、植物において極めて重要なオーキシンの輸送制御メカニズムの理解につなげたいと思います」と語っています。
<参考図>
-
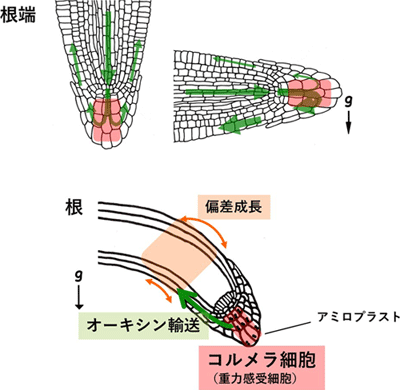
図1 シロイヌナズナ根の重力屈性反応 - 上:根端でのコルメラ細胞(重力感受細胞)の位置(赤)とオーキシンの流れ(緑矢印)。
- 下:重力感受細胞から、器官の偏差成長に至る情報の流れを示した。
-
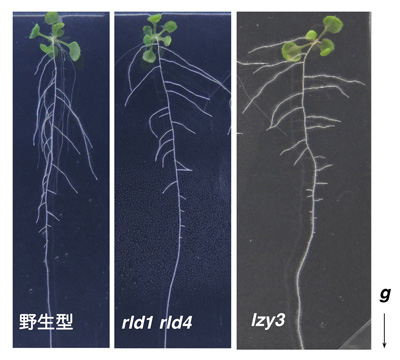
図2 シロイヌナズナ側根の伸長方向 野生型に比べて、rld1 rld4二重変異体、lzy3変異体では側根が水平方向に向かう傾向にある。
-
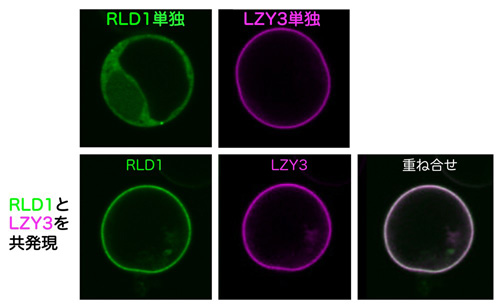
図3 LZYによってRLDは細胞膜へと局在を変える - 上:培養細胞をプロトプラスト化し、RLD1とLZY3をそれぞれ単独で発現した。RLD1は細胞質に、LZY3は細胞膜に局在している。
- 下:RLD1とLZY3を同時に発現させると、RLD1はLZY3とともに細胞膜に局在する。
-
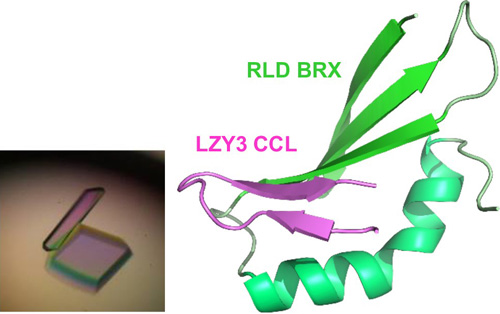
図4 蛋白質複合体構造 - 左:LZY CCLドメインとRLD BRXドメインの蛋白質複合体結晶
- 右:CCL−BRX複合体のX線結晶構造
-
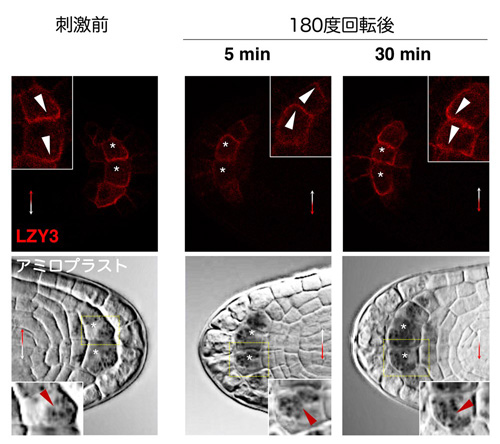
図5 LZY3は重力方向側の細胞膜に局在する - 上:若い側根を固定・透明化してLZY3を観察した。刺激前にLZY3は重力側の細胞膜に偏って存在する。180度回転して重力刺激を与え、5分後ではLZY3はまだ元の重力方向にあるが、30分後には新たな重力方向に偏って存在している。
- 下:アミロプラストは5分後にはあまり移動していないが、30分後には新たな重力方向に移動している。
*;中央コルメラ細胞、白矢じり;LZY3の極性局在、赤矢じり;アミロプラスト。
-
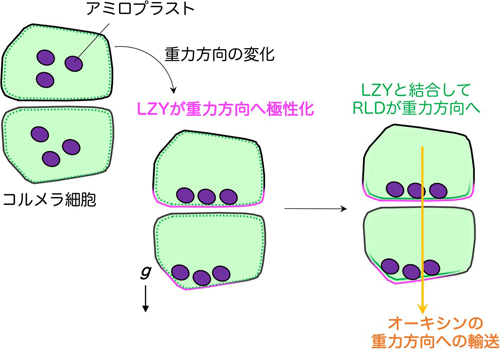
図6 側根コルメラ細胞での重力シグナル伝達 -
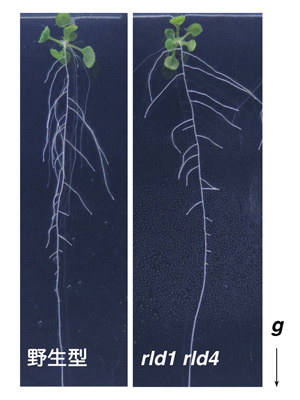
図 通常、植物の根は重力の方向を感じ取り、重力の方向に従って伸びる重力屈性を示す(左:野生型)が、rld1 rld4二重変異体(右)では、重力屈性が弱く、側根が水平方向に向かう傾向が見られる。
<論文タイトル>
- “Polar recruitment of RLD by LAZY1-like protein during gravity signaling in root branch angle control”
(側根の伸長角度調節における重力シグナリング過程でLAZY1様蛋白質はRLD蛋白質に極性を持たせる) - 著者:Masahiko Furutani, Yoshinori Hirano, Takeshi Nishimura, Moritaka Nakamura, Masatoshi Taniguchi, Kanako Suzuki, Ryuichiro Oshida, Chiemi Kondo, Song Sun, Kagayaki Kato, Yoichiro Fukao, Toshio Hakoshima, Miyo Terao Morita
- DOI:10.1038/s41467-019-13729-7
<お問い合わせ先>
-
<研究内容に関すること>
森田(寺尾) 美代(モリタ(テラオ) ミヨ)
基礎生物学研究所 植物環境応答研究部門 教授
Tel:0564-55-7556
E-mail:mimoritanibb.ac.jp
西村 岳志(ニシムラ タケシ)
基礎生物学研究所 植物環境応答研究部門 助教
Tel:0564-55-7557
E-mail:ta-nishinibb.ac.jp
古谷 将彦(フルタニ マサヒコ)
福建農林大学 生命科学学院 教授
Tel:+86-183-5010-2151
E-mail:ma-furutfafu.edu.cn
平野 良憲(ヒラノ ヨシノリ)
東京大学 大学院薬学系研究科 蛋白構造生物学教室 助教
Tel:03-5841-4841
E-mail:y-hmol.f.u-tokyo.ac.jp
-
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:crestjst.go.jp
-
<報道担当>
基礎生物学研究所 広報室
Tel:0564-55-7628 Fax:0564-55-7597
E-mail:pressnibb.ac.jp
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:jstkohojst.go.jp
