ポイント
- 腸内細菌と宿主免疫系がどのように共生しているか長い間不明であった。
- 大腸の制御性T細胞の増殖にはエピゲノム制御分子であるUhrf1が重要。
- 炎症性腸疾患の発症メカニズム解明に向けた画期的な一歩。
JST 課題達成型基礎研究の一環として、慶應義塾大学の長谷 耕二 教授(理化学研究所 客員主管研究員/東京大学 医科学研究所 非常勤講師)らは腸管の免疫細胞が腸内細菌注1)と共生するために必須の分子をマウスの実験で明らかにしました。
ほ乳類の胎児は母体内では無菌状態ですが、ヒトでは出生後直ちに100兆個にも及ぶ膨大な数の細菌にさらされます。生後の無菌環境から腸内細菌が定着する際には、過剰な免疫応答を抑えるための強力な免疫制御システムが働くと考えられています。免疫応答を抑制する細胞として、制御性T細胞注2)が知られています。しかし、どのような機構で制御性T細胞が活性化し、病理的な炎症が抑制され、腸内細菌と宿主免疫系の共生関係が構築されるのかは長い間不明でした。
長谷教授らは、無菌状態から腸内細菌が定着する際、大腸の制御性T細胞内のUhrf1注3)の発現量が高まることをマウスにおいて発見しました。さらに、T細胞においてのみUhrf1遺伝子が欠損したマウス(Uhrf1欠損マウス)では、制御性T細胞が増えなくなり、その結果、免疫抑制機能が弱く慢性大腸炎を発症しました。
このことから、Uhrf1分子は大腸の制御性T細胞が増殖し働く上で必須であることが分かり、宿主免疫系と腸内細菌が共生関係を築く重要なメカニズムが明らかになりました。また、今回の成果は、腸内細菌と免疫系のバランスの不均衡によって発症すると考えられている炎症性腸疾患注4)の病態解明や新たな治療法の開発に向けた基礎的知見として役立つものと期待されます。
本研究成果は、2014年4月28日(英国時間)に英国科学誌「Nature Immunology」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業
| 研究領域 |
「エピジェネティクスの制御と生命機能」
(研究総括:向井 常博 西九州大学 学長/佐賀大学 名誉教授) |
| 研究課題名 |
「腸内共生系におけるエピジェネティックな免疫修飾」 |
| 研究者 |
長谷 耕二(慶應義塾大学 薬学部 教授) |
| 研究実施場所 |
東京大学 医科学研究所/(独)理化学研究所 |
| 研究期間 |
平成22年10月~平成26年3月 |
<研究の背景と経緯>
腸管免疫系の最大の特色は、病原性細菌など有害な抗原には免疫応答を発動し排除する一方で、食物性たんぱく質、共生細菌など無害な抗原には反応しないような制御(経口免疫寛容)があることです。この免疫バランス制御の破綻が、食物アレルギーや炎症性腸疾患などの疾患発症の主因と考えられています。例えば、出生時から無菌状態で飼育したマウス(無菌マウス)では、腸管内の制御性T細胞のCD4陽性T細胞注5)からの分化・発達が未熟であり、経口免疫寛容も起こりにくくなっていることが知られています。このように共生細菌と宿主の相互作用は腸管免疫系の恒常性維持に重要であると考えられていましたが、その分子機構には不明な点が多く残されていました。
これまでの研究で、無菌マウスに腸内細菌を定着させると、大腸における制御性T細胞の分化と増殖が誘導されることが分かっていました。2013年に長谷教授らは、腸内細菌によって産生される酪酸注6)が大腸の制御性T細胞の分化を促進することを報告しています。一方で、酪酸は制御性T細胞の増殖には影響しないことから、大腸における制御性T細胞の分化と増殖は異なるメカニズムによって制御されると予想されていました。
<研究の内容>
長谷教授らは、まず大腸の制御性T細胞の増殖誘導機構を明らかにするため、無菌マウスに腸内細菌を投与し、投与されたマウスの大腸の機能を解析しました。その結果、腸内細菌の定着により、制御性T細胞が大腸局所で増殖していました(図1)。
次に、制御性T細胞の増殖メカニズムを詳しく調べるために、無菌マウスに腸内細菌を定着させる前後で、大腸の制御性T細胞の遺伝子発現パターンを比較解析しました。その結果、腸内細菌が定着すると、制御性T細胞ではUhrf1という分子の発現量が上昇していることが分かりました。
さらに、T細胞においてのみUhrf1が欠損している(Uhrf1欠損)マウスを作出し、正常な対照マウスと比較解析しました。すると、離乳直後のUhrf1欠損マウスの大腸において、制御性T細胞への分化は起こるものの増殖能が低く、制御性T細胞の数は顕著に減少していました(図2上)。また、Uhrf1欠損マウスの大腸に存在する制御性T細胞は、免疫抑制分子(IL-10など)の発現が低下していたことから(図2下)、Uhrf1が存在することで制御性T細胞は増殖し、働けることが明らかになりました。
続いて、なぜUhrf1が存在していると制御性T細胞が増殖するのか、そのメカニズムを解析しました。Uhrf1は、DNAが複製する際の、DNAメチル化注7)を維持することで遺伝子の発現パターンを親細胞から子細胞へ正確に伝える役割を持った、「エピゲノム制御因子」として知られています。そこで、大腸の制御性T細胞においてUhrf1がどの遺伝子の発現を制御しているか調べるため、Uhrf1を欠損する制御性T細胞と正常な制御性T細胞の網羅的なDNAメチル化解析および遺伝子発現解析を行いました。その結果、細胞周期制御因子であるCdkn1a がUhrf1の標的であり、Uhrf1が欠損しているとCdkn1a の発現が増加して、細胞増殖が起こりにくくなることが明らかになりました(図3)。
次に、Uhrf1の、生体の恒常性維持における役割を検討したところ、Uhrf1欠損マウスは、加齢とともにリンパ球浸潤と粘膜の肥厚を特徴とする慢性大腸炎を自然発症することが判明しました(図4)。大腸における制御性T細胞の数と機能の減弱により、炎症性の免疫細胞が異常に活性化した結果、慢性炎症が引き起こされていると考えられます(図5)。Uhrf1欠損マウスは無菌環境では大腸炎を発症しないため、腸内細菌に対する過剰な免疫応答が炎症の原因であると考えられます。また、正常なマウスから取得した制御性T細胞をUhrf1欠損マウスに移植すると慢性大腸炎の発症が抑えられたことから、この慢性炎症は制御性T細胞の異常により発症していると考えられました。
以上の結果から、Uhrf1は大腸の制御性T細胞の増殖と働きをサポートすることで、腸管のT細胞が腸内細菌に過剰に応答するのを防ぎ、大腸における免疫恒常性の維持に重要な役割を果たす分子であることが明らかとなりました(図6)。
<今後の展開>
難治性疾患である炎症性腸疾患(クローン病や潰瘍性大腸炎)は消化管の慢性炎症であり、その完全な発症メカニズムや発症原因は不明です。近年の食生活の欧米化に伴って日本人の患者数は毎年増加しており、根本的な治療方法が望まれています。今回の研究により、エピゲノム制御因子であるUhrf1が大腸における制御性T細胞の増殖を誘導し、腸管の炎症を防ぐ重要な分子であることが分かりました。この成果は、炎症性腸疾患の発症メカニズムの解明に寄与するとともに、その治療法の開発にも役立つと期待できます。
<付記>
本研究は、東京大学 医科学研究所(尾畑 佑樹、古澤 之裕、藤村 由美子)、理化学研究所 統合生命医科学研究センター(遠藤 高帆、Jafar Sharif、高橋 大輔、新 幸二、大縄 悟、高橋 ますみ、伊川 友活、小原 收、本田 賢也、堀 昌平、大野 博司、古関 明彦)、かずさDNA研究所(中山 学)、国立国際医療センター(土肥 多惠子、河村 由紀、大坪 武史)、大阪大学(田嶋 正二)の研究者各氏との共同で行われました。
<参考図>(Nature Immunology誌より許可を得て掲載)
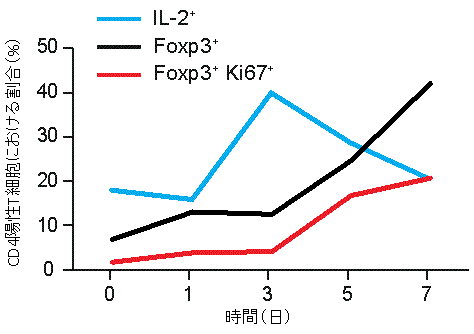
図1 無菌マウスに腸内細菌を定着させた際の大腸CD4陽性T細胞の動態
無菌マウスに腸内細菌を定着させたところ、IL-2を産生するCD4陽性T細胞が一時的に増えた(青線)。また、制御性T細胞(黒線)と増殖している制御性T細胞(赤線)の割合が増加し、7日目にはCD4陽性T細胞の大部分が制御性T細胞となった。
IL-2…CD4陽性T細胞を制御性T細胞に分化させるために必要な分子。
Foxp3…制御性T細胞であることを示す分子。
Ki67…細胞増殖が起こっていることを示す分子。
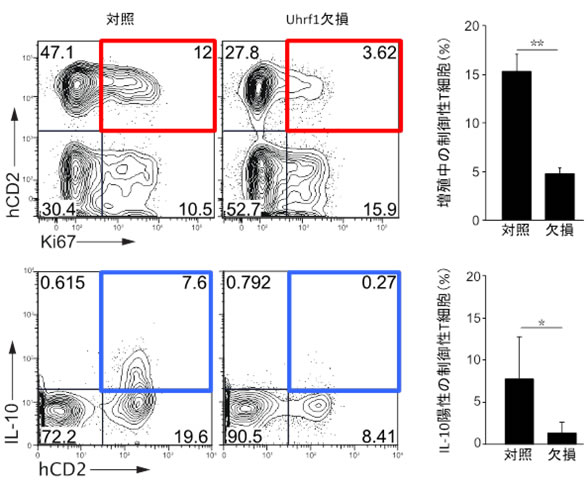
図2 Uhrf1欠損マウスの大腸粘膜固有層内の制御性T細胞の解析
- 上段(左)対照マウスの制御性T細胞と比べUhrf1欠損マウスの大腸の制御性T細胞では、
細胞増殖が減少した(赤四角)。
(右)左図の解析を複数回実施し、ヘルパーT細胞全体に占める増殖中の制御性T細胞
の割合を平均化したグラフ。
- 下段(左)免疫抑制機能分子であるIL-10の発現も弱くなっていた(青四角)。
(右)左図の解析を複数回実施し、ヘルパーT細胞全体に占めるIL-10を産生する制御
性T細胞の割合を平均化したグラフ。
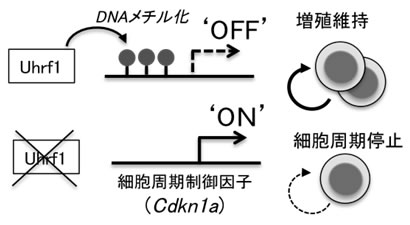
図3 Uhrf1によるDNAメチル化を介した細胞増殖制御
- (上段)Uhrf1が存在する正常の制御性T細胞では、DNAメチル化を介してCdkn1a の発現が
抑制されている。
- (下段)Uhrf1を欠損する制御性T細胞では、DNAメチル化を介した抑制機構が働かないた
め、Cdkn1a の発現が上昇し細胞周期が停止する。
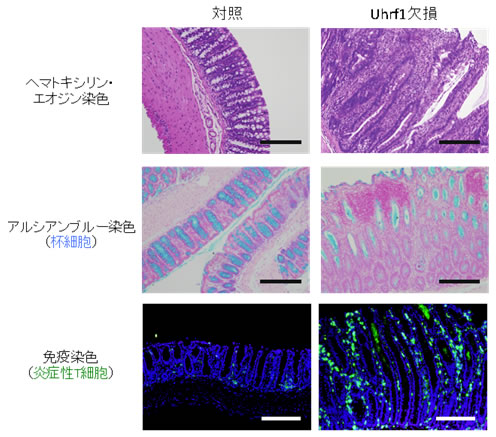
図4 Uhrf1欠損マウスにおいて自然発症する大腸炎の組織解析
Uhrf1欠損マウスの大腸では、炎症細胞の浸潤と青色に染まる杯細胞(粘液産生細胞であり炎症により減少する)の消失が認められる(中段右)。また、Uhrf1欠損マウスでは炎色性の免疫細胞浸潤(緑色)が顕著に認められる(下段右)ことから、Uhrf1欠損マウスは大腸炎を発症していることが分かる。
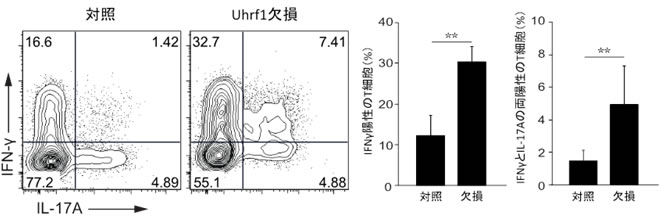
図5 Uhrf1欠損マウスにおいて自然発症する大腸炎の免疫学的表現型
- 左)Uhrf1欠損マウスの大腸のCD4陽性T細胞では、炎症性サイトカイン(IFN-γ、IL-17A)の発現が顕著に増加していた。
- 右)左図に示す解析を複数回実施し、炎症性サイトカインを産生するT細胞の割合を平均化したグラフ。
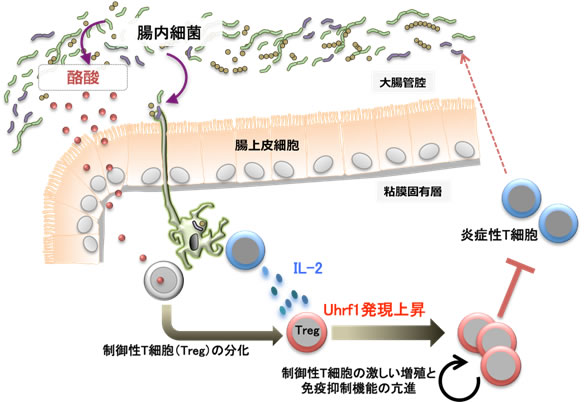
図6 Uhrf1による大腸の制御性T細胞の恒常性維持メカニズム
制御性T細胞の分化は腸内細菌由来の酪酸により促進する。今回の研究から、腸内細菌の定着がCD4陽性T細胞(青)におけるIL-2の産生を促し、これにより制御性T細胞におけるUhrf1の遺伝子発現が誘導されることが示された。Uhrf1が発現すると制御性T細胞は激しく増殖するようになり免疫抑制機能が高まる。この機構は腸内細菌に対する過剰な免疫応答を抑制するのに必須であり、このためUhrf1欠損マウスは、炎症性腸疾患を自然発症する。
<用語説明>
- 注1)腸内細菌
- ヒトをはじめとする動物の腸内には膨大な数の細菌群が生息しており、これらの細菌群を総称して腸内細菌叢(腸内フローラ)と呼ぶ。大腸はこれら腸内細菌が増殖するのに非常に適した環境であり、主として嫌気性の細菌が糞便1gあたり約1,000億個という極めて高密度で生息している。これら大腸に存在する腸内細菌は、活発な微生物発酵によって、小腸では消化吸収されない食物繊維や難消化性デンプン、オリゴ糖などを分解し、最終代謝産物として多量の短鎖脂肪酸などを産生する。
- 注2)制御性T細胞
- 炎症やアレルギーの発端となる過度の免疫応答を抑制するT細胞。Foxp3というマスター転写因子を発現し、Foxp3の発現の有無は制御性T細胞のマーカーとして用いられる。一般にT細胞は免疫系の司令塔として免疫活性化に働くが、制御性T細胞はほかのT細胞の働きを抑制性に制御することにより(この働きが制御性T細胞の名前の由来である)、過剰なT細胞の働きを抑えることで、炎症の収束や自己免疫疾患発症抑制に重要である。制御性T細胞への細胞分化はエピジェネティックな制御機構により緻密に調節されている。
- 注3)Uhrf1
- DNA複製の際、DNA上のメチル化基(遺伝子発現を制御する化学的目印)を認識し、維持メチル化酵素であるDNAメチル化転移酵素-1(Dnmt1)を導くことで、複製後のDNA鎖においても複製前と同じ位置にメチル化が起こるようにする。Uhrf1を欠損した細胞では、細胞分裂前後でDNAのメチル化が維持されず、遺伝子発現制御が変化することが予想される。
- 注4)炎症性腸疾患
- 主としてクローン病と潰瘍性腸疾患に分けられ、どちらも厚生労働省より特定疾患に指定されている。2011年時点の患者数は、クローン病が約3万5千人、潰瘍性大腸炎が約13万4千人であり、年々増加している(出典:難病情報センターホームページ)。クローン病は主として口腔から肛門までの全消化管に、非連続性の慢性炎症を生じる原因不明の疾患である。根治することはなく、発症機序は正確には解明されていない。遺伝的な素因、免疫系の異常のほか、腸内の細菌叢、食習慣が複合的に関与している。一方、潰瘍性大腸炎は、若年者に好発する炎症性腸疾患であり、持続性または反復性の下痢、下血、発熱、腹痛を主症状とし、粘血便を呈する。潰瘍性大腸炎の病変は直腸から連続性に存在するが、基本的に大腸に限局する。
- 注5)CD4陽性T細胞
- B細胞を活性化させて抗体産生を促すほか、マクロファージを活性化してより効率的に貪食能を高める細胞。このようにさまざまな免疫応答の発動を助けるために、ヘルパーT細胞とも呼ばれる。
- 注6)酪酸
- 腸内細菌により分解産生される主要な代謝物である短鎖脂肪酸の1つ。大腸の内腔における短鎖脂肪酸の濃度は合わせて100mM(ミリモーラー)にもなり、そのうち酪酸は10~15mM程度である。短鎖脂肪酸は大腸上皮細胞のエネルギー源として使われる。
- 注7)DNAメチル化
- 遺伝子の発現を抑制するエピゲノム修飾機構の1つとして知られ、発生、細胞分化、がん、免疫応答など多くの生命現象に関与する。
<論文タイトル>
“The epigenetic regulator Uhrf1 facilitates proliferation and maturation of colonic regulatory T cells”
(エピゲノム制御因子Uhrf1は大腸における制御性T細胞の増殖と成熟を促進する)
doi:10.1038/ni.2886
<お問い合わせ先>
<研究に関すること>
長谷 耕二(ハセ コウジ)
慶應義塾大学 薬学部 教授
(東京大学 医科学研究所 国際粘膜ワクチン開発研究センター 非常勤講師)
〒105-8512 東京都港区芝公園1-5-30
Tel:03-5400-2484(慶應義塾大学) 、03-6409-2390(東京大学) Fax:03-6409-2391
E-mail:
<JSTの事業に関すること>
松尾 浩司(マツオ コウジ)、川口 貴史(カワグチ タカフミ) 、峯 裕一(ミネ ユウイチ)
科学技術振興機構 戦略研究推進部 ライフイノベーション・グループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2063
E-mail:
<報道対応>
独立行政法人 科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:
独立行政法人 理化学研究所 広報室 報道担当
Tel:048-467-9272 Fax:048-462-4715
E-mail:
慶應義塾 広報室
Tel:03-5427-1541 Fax:03-5441-7640
E-mail: