JST 課題達成型基礎研究の一環として、東京大学 大学院薬学系研究科の池谷 裕二 准教授らの研究グループは、今回新たに開発した技術により、脳の神経回路が、回路を形成する神経細胞「ニューロン」(図1)より小さく、シナプス(ニューロンが情報交換する場所)の単位で正確に編まれることで機能を発揮することを、世界で初めて明らかにしました。
脳の働きの基本には、ニューロン同士が巧みにつながり「配線」された神経回路があることが知られています。しかし、どこまで微細な構造のレベルまで機能的な配線がなされているかについては知られていませんでした。
池谷准教授らは、多くのシナプス活動を観察できる新しい撮影技術「大規模スパインイメージング法」を開発しました。この手法により、ニューロンが1000分の1mmレベルで局所集中した回路を正確に編んでいることを証明し、数十年に及んだ神経科学界の重要な議論に1つの目途をつけることができました。また、幾つかの状況証拠から、「LTP」という学習プロセスによって、精度の高い配線が実現することを示すこともできました。
本研究成果により、脳が極めて精細な配線メカニズムに基づいて回路を編成するという画期的な発見がもたらされ、脳がどのように機能を発揮するかの解明に向けた大きな研究の進展が得られました。今後、この方法を活用して記憶・学習のメカニズムや神経疾患の原因の解明に役立つことが期待されます。
本研究成果は、2012年1月20日(米国東部時間)発行の米国科学誌「サイエンス」に掲載されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 個人型研究(さきがけ)
| 研究領域 |
「脳情報の解読と制御」
(研究総括:川人 光男 (株)国際電気通信基礎技術研究所(ATR) 脳情報通信総合研究所 所長/ATR フェロー)
|
| 研究課題名 |
「神経回路網が示す自発的可塑性のルール抽出と制御」 |
| 研究者 |
池谷 裕二(東京大学 大学院薬学系研究科 准教授) |
| 研究期間 |
平成21年10月~平成23年3月 |
JSTはこの領域で、運動や判断を行っている際の脳内情報を解読し、外部機器や身体補助具などを制御するブレイン・マシン・インターフェイス(BMI)を開発し、障害などにより制限されている人間の身体機能を回復するための従来にない革新的な要素技術の創出に貢献する研究を支援しています。
上記研究課題では、回路編成の法則を発見することで自発活動のパターンを予測し、さらに自由自在にパターン情報を書き込むことを目指します。
<研究の背景と経緯>
脳はニューロンと呼ばれる神経細胞からなり、各々のニューロンが、少しずつ情報を処理しています。その処理結果は、ニューロン間の特殊な結合(シナプス)を介して、次のニューロンに伝えられます(図1)。
ニューロンには多くの樹状突起と呼ばれる枝分かれした線維があり、ここにあるシナプスは、樹状突起の先端部分「スパイン」と呼ばれる突出構造を介してほかのニューロンからの情報を受け取ります。樹状突起は複雑に分岐するだけでなく、種々のイオンチャネル注1)や受容体注2)を持つため、「どのスパインが、いつ、どんな入力を受けたのか」が、ニューロンの情報処理に大きく影響します。
ニューロンは主として樹状突起からの入力を受けますが、樹状突起上のシナプス配置のパターンについては、現在、2つの仮説が提唱されています(図2)。1つは、同期した入力(ほぼ同時刻に来る入力)は樹状突起上のある特定の箇所に集中するという「クラスター入力モデル」(仮説1)で、もう1つは、同期した入力が樹状突起全体に散在している「分散入力モデル」(仮説2)です。仮説1はニューロンの一部を強く活動させるためには有利とされていますが、仮説2は情報のロスが少ないという利点があります。いずれのモデルが正しいのかについては、数十年来の議論の的となっているものの、これを検証するための実験技術がなかったため、これまでに明確な解答は得られていませんでした。
<研究の内容>
活動している神経細胞を観測するために現在広く利用されている手法は「カルシウムイメージング法」と呼ばれるもので、活動している神経細胞を検出するため、活動時に細胞内で遊離されるカルシウムイオンの存在により蛍光を発する色素(カルシウム蛍光指示薬)を用います。しかし、この蛍光は微弱なため、従来の手法では強いレーザー光を当てることによって観察中に細胞が死んでしまうのを回避することはできませんでした。今回、池谷准教授らは、抗酸化剤を用いることで死滅する細胞を減らし、また光透過性の高い光学レンズと超高感度のデジタルカメラを用いるなど、多くの改良を行い、「大規模スパインイメージング法」を開発しました。その結果、多数のシナプスから一斉にカルシウム活動を計測することができるようになりました。
この手法をもとに池谷准教授らは、海馬注3)のスライス培養標本のニューロン内にカルシウム蛍光指示薬を注入し(図3、ステップ1)、多くのスパインからの蛍光変化を高感度CCDカメラにより同時に記録することで、「どのスパインが、いつ、どんな入力を受けたのか」を調べました。従来は数個のスパインを観察することが限界でしたが、「大規模スパインイメージング法」により、同時に数百個ものスパインからシナプス活動を計測することに成功しました。これは過去の記録を2桁も更新するもので、この手法の開発により、広い範囲のシナプス活動を、時間を追って観察することができるようになりました。
シナプス活動を観察していると、近傍のスパインがしばしば同時に活動していることが分かりました。統計解析を行ったところ、8μm以内の近接スパインが有意に同期活動しやすいことを見いだしました。この現象は世界で初めて確認されたものです。以降では、この空間的に集まった同期活動を「クラスター入力」と呼びます。クラスター入力は、海馬スライス培養標本のみならず、生体内の大脳皮質でも確認できたことから、海馬だけの特殊な現象ではなく、脳部位を超えて広く観察される現象であると考えられます。
クラスター入力を生むためには、神経回路はシナプスレベルで正確に編まれている必要があります(図2左)。観察の結果、クラスター入力を受けるスパインは、そうでないスパインに比べて大きいことが判明しました。スパインの大きさは、LTP(注:シナプス可塑性の一種で記憶の素過程と考えられています)を経験したかどうかに関連し、また、シナプス結合の強さと相関します。このことからクラスター入力はLTPの結果として生じていることが示唆されました。実際、海馬シナプス培養標本をNMDA受容体(注:LTP形成に関与する分子)の阻害薬で処置して培養したところ、クラスター入力は観察されませんでした。以上のことから、クラスター入力は、NMDA受容体を介したシナプス回路の編成の結果、生じることが示唆されました。
そこで、LTPが樹状突起でどのような空間パターンで生じるかを、遺伝子改変動物を用いて解析しました。AMPA受容体注4)はLTPに伴ってスパインに運ばれることが知られています。そこで、AMPA受容体とGFPが結合した遺伝子に、任意のタイミングで発現させることができる工夫を加えた遺伝子をマウスに導入し、実験を行うこととしました。このマウスを、先の遺伝子を発現させないまま育てて、ある時、育った環境と異なる新しい環境へ置き、500秒間自由に探索させます。新しい環境下ではマウスはいろいろ学習をする必要があり、脳内でLTPが起こります。この実験の直前に先の遺伝子を発現させることで、この学習の結果起こったLTPだけを観察することができます。
この実験結果(図4)を解析したところ、互いに近いところにあるスパイン群でLTPが生じていたことが判明しました。これはLTPが隣接したシナプスで生じやすいことを世界で初めて示したものです。
今回の実験結果を、これまでの回路発達に関する知見も踏まえて考察すると、クラスター入力は3つのステップによって成立していると推定されます(図5)。すなわち、(1)まずはランダムに回路が作られる、(2)シナプスの要・不要が判定される、(3)不要なシナプスが削り取られるという順次過程です。ステップ2に今回発見された局所的なLTPが貢献すると考えられます。その後、ステップ3の淘汰過程を経ることで、クラスター入力を生み出す回路が選択的に残るのだろうと思われます。
<今後の展開>
本研究では、同期した神経入力が互いに近傍にあるシナプスに収束することが示されました。この発見は、脳内の情報の流れが驚くほど正確に制御されていることを示します。図2の仮説1が正しいことが支持され、数十年に及んだ神経科学界の重要な議論に1つの目途がついたと言えます。
クラスター入力は、樹状突起上での非線形的な加算を促すため、「個々のニューロンが持つ演算能力を高める」ことに役立つと考えられます。この演算能力が可塑性によって生じることから、クラスター入力は記憶・学習能に関わる基本的な生理メカニズムであると考えられます。今後は、認知症、統合失調症、うつ病など、記憶の変調を伴う疾患において、クラスター入力がどう変化しているかを観察していくという新たなアプローチが、精神神経疾患の病態に有益な解釈をもたらすと期待されます。
<参考図>
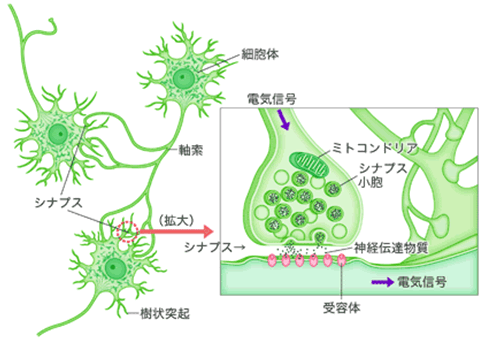
図1 ニューロンとシナプスの基本構造
ニューロンは、樹状突起が広がる細胞体部分と、そこから長く伸びる軸索とで構成され、ほかのニューロンから受け取った情報を処理して、ほかのニューロンに伝えていく。シナプス部分では、神経伝達物質を使って情報をほかのニューロンに伝える。
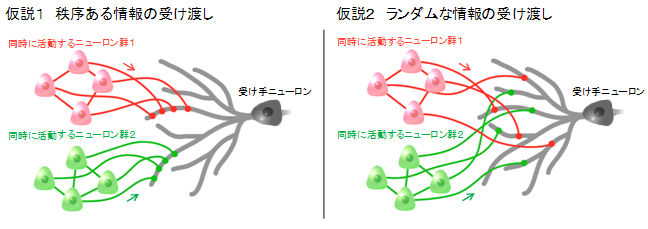
図2 本研究は上記2つの仮説のうち仮説1が正しいことを証明した
左図では、同期するニューロン仲間が、相手ニューロンの線維の近くに集中的に投射している。右図では、そのような秩序は見られない。このどちらの図が正しいかが、長らく議論の的になっていた。
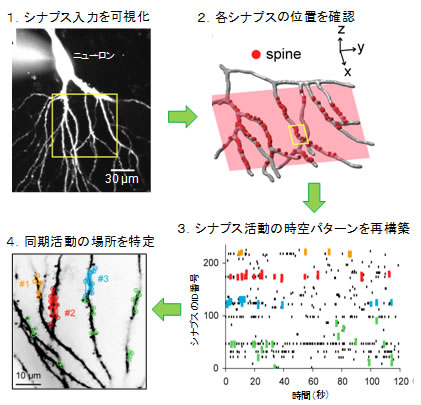
図3 大規模なスパインイメージング法を確立した
- ステップ1:シナプス入力をスパインのカルシウム活動として撮影した。
- ステップ2:撮影後にスパインの位置を3次元的に再構築して、各シナプスの距離を測定した。
- ステップ3:活動パターンを図に表して、時空構造(特に同期活動)を解析した。
- ステップ4:同期活動したシナプスを空間プロットしたところ、近傍のシナプスが同時に活動することが判明した。
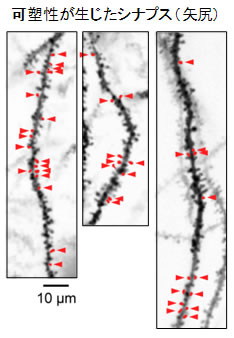
図4 シナプス可塑性(LTP)が近傍のスパインで生じることを、遺伝子改変マウスを用いて示した
- 赤の矢尻で示されているものがLTPの生じたスパイン。
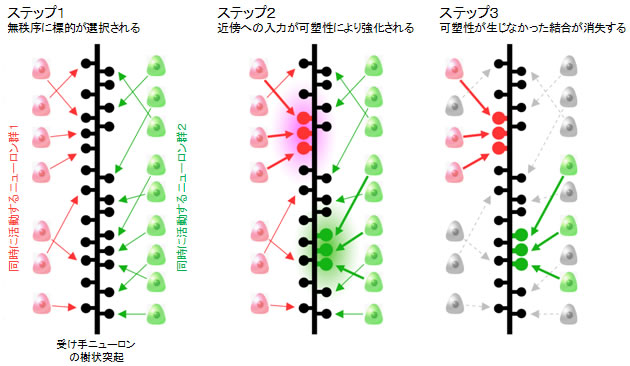
図5 クラスター入力を生じさせるために想定される3つのステップを示した
- ステップ1:初期のニューロン回路では、結合相手の選定は無秩序である。
- ステップ2:たまたま近くに同期入力を与えるような結合ができた場合、LTPが生じて強化される。
- ステップ3:強化されなかったシナプスが消えることで、図2の仮説1のような回路が残存する。
<用語解説>
- 注1) イオンチャネル
- 細胞の生体膜(細胞膜や内膜など)にある膜貫通たんぱく質の一種で、受動的にイオンを透過させるたんぱく質の総称。
- 注2) 受容体
- 生物の体にあって、外界や体内からの何らかの刺激を受け取り、情報として利用できるように変換する仕組みを持った構造のこと。
- 注3) 海馬
- 大脳の古皮質の一部で、記憶や学習を司っている。近年ではうつ病などの精神疾患にも関与することが知られるようになっている。
- 注4) AMPA受容体
- グルタミン酸受容体の一種で、グルタミン酸を用いるシナプスでは最も主要な受容体。この受容体の数がシナプス結合の強さを決定し、学習によって増減する。
<付記>
本成果の一部は、
- 喜多村 和郎(東京大学 大学院医学系研究科)
- 狩野 方伸(東京大学 大学院医学系研究科)
- 松尾 直毅(京都大学 次世代研究者育成支援事業「白眉プロジェクト」)
- マーク・メイフォード(米国・スクリプス研究所)
から提供されたデータを、池谷らが解析したものです。
<論文名>
“ Locally synchronized synaptic inputs ”
(局所同期したシナプス入力)
doi: 10.1126/science.1210362
<お問い合わせ先>
<研究に関すること>
池谷 裕二(イケガヤ ユウジ)
東京大学 大学院薬学系研究科 薬品作用学教室 准教授
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-4783 Fax:03-5841-4786
E-mail:
<JSTの事業に関すること>
原口 亮治(ハラグチ リョウジ)、木村 文治(キムラ フミハル)、稲田 栄顕(イナダ ヒデアキ)
科学技術振興機構 イノベーション推進本部 研究推進部(研究推進担当)
〒102-0076 東京都千代田区五番町7 K’s五番町ビル
Tel:03-3512-3525 Fax:03-3222-2067
E-mail: